
题目列表(包括答案和解析)
20.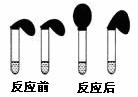 (10分)甲、乙两位同学设计用实验确定某酸HA是弱电解质,存在电离平衡,且改变条件平衡发生移动。实验方案如下:
(10分)甲、乙两位同学设计用实验确定某酸HA是弱电解质,存在电离平衡,且改变条件平衡发生移动。实验方案如下:
甲:取纯度相同,质量、大小相等的锌粒于两只试管中,同时加入0.1 mol·L-1的 HA、HCl溶液各10 mL,按图装好,观察现象
乙:① 用pH计测定物质的量浓度均为0.1 mol·L-1 HA和HCl溶液的pH;
② 再取0.1 mol·L-1的HA和HCl溶液各2滴(1滴约为1/20 mL)分别稀释至100 mL,再用pH计测其pH变化
(1)乙方案中说明HA是弱电解质的理由是:测得0.1 mol·L-1的HA溶液的pH 1(填“>”、“<”或“=”) ;甲方案中,说明HA是弱电解质的实验现象是:
A.加入HCl溶液后,试管上方的气球鼓起快
B.加入HA溶液后, 试管上方的气球鼓起慢
C.加入两种稀酸后,两个试管上方的气球同时鼓起,且一样大
(2)甲同学为了证明弱电解质电离平衡移动的情况,设计如下实验:①使HA的电离程度和c(H+)都减小, c(A-)增大,可在0.1 mol·L-1的HA溶液中,选择加入_________试剂;②使HA的电离程度减小,c(H+)和c(A-)都增大,可在0.1 mol·L-1的HA溶液中,选择加入_____试剂。
A. NaA固体(可完全溶于水) B.1 mol·L-1 NaOH溶液
C. 1 mol·L-1 H2SO4 D.2 mol·L-1 HA
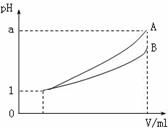 (3) pH=1的两种酸溶液A、B各1 mL,分别加水稀释到1000 mL,其pH与溶液体积V的关系如图所示,则下列说法不正确的有
(3) pH=1的两种酸溶液A、B各1 mL,分别加水稀释到1000 mL,其pH与溶液体积V的关系如图所示,则下列说法不正确的有
A.两种酸溶液的物质的量浓度一定相等
B.稀释后,A酸溶液的酸性比B酸溶液弱
C.若a=4,则A是强酸,B是弱酸
D.若1<a<4,则A、B都是弱酸
19.(10分)在一个固定容积的密闭容器中,在一定温度下发生下列反应:A(g)+B(g)  2C(g),起始加入1molA和2molB,反应达到平衡后测得C的浓度为p mol/L,且C的体积分数为w。在相同条件下:
2C(g),起始加入1molA和2molB,反应达到平衡后测得C的浓度为p mol/L,且C的体积分数为w。在相同条件下:
(1)若在同一容器中加入2molA和4molB,达平衡后,C的物质的量浓度为________mol/L;
(2)若在同一容器中加入0.5molC,要求平衡后C的浓度为0.5p mol/L,且C的体积分数为w,则还应在容器中加入A________mol,B________mol;
(3)若在同一容器中加入a mol A、b mol B、c mol C,并要求平衡后C的浓度为p mol/L,C的体积分数仍为w,则a、b、c应符合的关系是_____________ _____________(其中一个只含a和b,另一个只含a和c)。
18.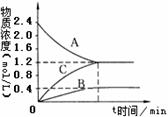 (8分)右图表示800℃时,A、B、C三种气体物质的浓度随时间变化的情况,t是达到平衡状态的时间。试回答:
(8分)右图表示800℃时,A、B、C三种气体物质的浓度随时间变化的情况,t是达到平衡状态的时间。试回答:
(1)该反应的化学方程式是 。
(2)若达到平衡状态的时间为2min,则A的平均速率是
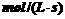 ,平衡时A转化率α(A)%=____________ ,该温度下反应的平衡常数k = ____________
,平衡时A转化率α(A)%=____________ ,该温度下反应的平衡常数k = ____________
17.一定温度下,向盛有催化剂的(体积不变)密闭容器中通入一定量的SO3气体,反应达平衡时,测得SO3的分解率为50%,下列说法错误的是
A.平衡时压强为起始时压强的1.25倍 B.平衡混合气体的平均相对分子质量为64
C.混合气体的密度自始至终保持不变
D.取与SO3等质量的SO2和O2的混合气体;从逆反应开始并达平衡。在相同条件下,各物质的浓度与原来的平衡浓度一定相同。
16.某强酸溶液pH=a,强碱溶液pH=b,已知a+b=12,酸碱溶液混合后pH=7,则酸溶液体积V(酸)和碱溶液体积V(碱)的正确关系为
A. V(酸) = 102 V(碱) B. V(碱) = 102 V(酸)
C. V(酸) = 2V(碱) D. V(碱) = 2V(酸)
15.用0.1 mol·L-1 NaOH溶液滴定0.1 mol·L-1盐酸,如达到滴定的终点时不慎多加了1滴NaOH溶液(1滴溶液的体积约为0.05 mL),继续加水至50 mL,所得溶液的pH是
A. 4 B. 7.2 C. 10 D. 11.3
14.某同学在实验报告中有以下实验数据,其中合理的是
A.用托盘天平称取14.60g食盐 B.用量筒量取6.16ml盐酸
C.用PH试纸测得溶液的PH是3.5
D.用标准NaOH溶液滴定未知浓度的盐酸用去23.10ml NaOH溶液
13.下列四种溶液 ① c(H+)=1mol/L的醋酸 ② 0.1mol/L的盐酸 ③ 0.01mol/L的NaOH溶液 ④ c(OH-)= 10-3mol/L 氨水溶液由水电离出的氢离子浓度之比为
A.1∶10∶100∶1000 B.0∶1∶12∶11 C.14∶13∶12∶11 D.14∶13∶2∶3
12.由一价离子组成的四种盐溶液:AC、BD、AD、BC,浓度均为0.1 mol·L-1。在室温下,前两种溶液的pH=7,第三种溶液的pH>7,最后一种溶液的pH<7。下列各组酸、碱性比较正确的是
|
|
A |
B |
C |
D |
|
碱性 酸性 |
AOH>BOH HC>HD |
AOH<BOH HC>HD |
AOH>BOH HC<HD |
AOH<BOH HC<HD |
11.对于达到平衡的反应:2A(g)+B(g)  nC(g),
nC(g),
符合右图所示的结论是
A.P1>P2,n>3 B.P1>P2,n<3
C.P1<P2,n>3 D.P1<P2,n<3
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com