
题目列表(包括答案和解析)
7.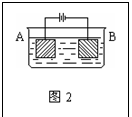 按图2的装置进行电解实验:A极是铜锌合金,B极为纯铜,
按图2的装置进行电解实验:A极是铜锌合金,B极为纯铜,
电解质中含 有足量的铜离子。通电一段时间后,若A极恰好
全部溶解,此时B极质量增加7.68克,溶液质量增加0.03克,
则A合金中Cu、Zn原子个数比为
A 4︰1 B 3︰1 C 2︰1 D 任意比
6.关于电解NaCl水溶液,下列叙述正确的是( )
A.若在阴极附近的溶液中滴入酚酞试液,溶液呈无色
B.若在阳极附近的溶液中滴入KI溶液,溶液呈棕色
C.电解时在阳极得到氯气,在阴极得到金属钠
D.电解一段时间后,将全部电解液转移到烧杯中,充分搅拌后溶液呈中性
5.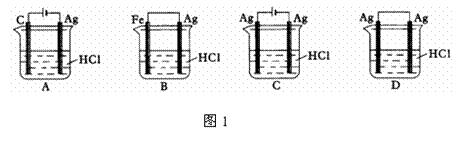 某同学为了使反应2HCl + 2Ag
某同学为了使反应2HCl + 2Ag 2AgCl
+ H2↑能进行,设计了下列四个实验,如图1所示,你认为可行的方案是( )
2AgCl
+ H2↑能进行,设计了下列四个实验,如图1所示,你认为可行的方案是( )
4.充分燃烧某液态芳香烃X,并收集产生的全部水,恢复到室温,得到水的质量跟原芳香烃X的质量相等。则X的分子式是 ( )
A.C10H14 B. C11H16 C.C12H18 D.C13H20
3.将 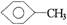 和
和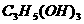 (甘油)以一定比例混合,测得混合物含碳51.3%,那么氧元素的质量分数是
(
)
(甘油)以一定比例混合,测得混合物含碳51.3%,那么氧元素的质量分数是
(
)
A.40% B.35% C.30% D.无法计算
2.在由5种基团-CH3、-OH、-CHO、-C6H5、-COOH两两组成(不包括自身组合)的物质中,能与NaOH反应的有机物有 ( )
A.4种 B.5种 C.6种 D.7种
1.有机物A和B,只由C、H、O两种或三种元素组成,相同物质的量的A和B完全燃烧时,消耗氧气的物质的量相等,下列对A、B的判断错误的是 ( )
A.A与B可互为同分异构体 B.A与B的分子组成可相差n个“CH2”
C.A与B的分子组成可相差n个“CO2” D.A与B的分子组成可相差n个“H2O”
25.(6分)计算:
(1) pH=13的氢氧化钠与pH=10的氢氧化钡溶液按体积比11:100混合后,
pH=_____________
(2).在一定条件下,CH4 和CO的燃烧的热化学方程式分别为:
CH4(g)+ 2O2(g )=2H2O(l)+ CO2(g) △H=-890 kJ/mol
2CO(g)+ O2(g )=2CO2(g) △H=-566 kJ/mol
一定量的CH4和CO的混合气体完全燃烧时,放出的热量为262.9kJ,生成的CO2用过量的饱和石灰水完全吸收,可得到50 g白色沉淀。混合气体中CH4 和CO的体积比为___________。
(3) NH3加热分解为N2,在相同条件下,测得分解后混合气体密度为分解前的2/3,则
24.(12分)
向一定体积的密闭容器中加入2molA、0.6molC和一定量的B三种气体。一定条件下发生反应,各物质浓度随时间变化如图I所示,其中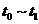 阶段
阶段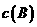 未画出。图Ⅱ为
未画出。图Ⅱ为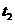 时刻后改变反应条件,化学反应速率随时间变化的情况,四个阶段改变的条件均不相同,每个阶段只改变浓度、温度、压强、催化剂中的一个条件,其中
时刻后改变反应条件,化学反应速率随时间变化的情况,四个阶段改变的条件均不相同,每个阶段只改变浓度、温度、压强、催化剂中的一个条件,其中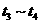 阶段为使用催化剂。
阶段为使用催化剂。
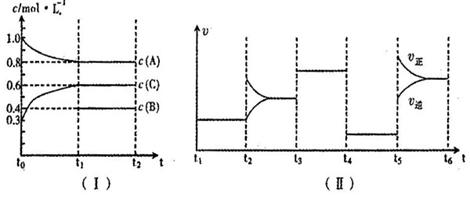
请回答下列问题:
(1)若 ,则
,则 阶段以C物质的浓度变化表示的反应速率为_________;
阶段以C物质的浓度变化表示的反应速率为_________;
(2) 阶段改变的条件为___________,B的起始物质的量浓度为______________。
阶段改变的条件为___________,B的起始物质的量浓度为______________。
各阶段平衡时对应的平衡常数如下表所示:
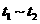
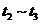
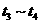
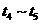
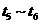
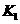
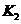
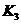
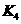
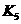
则 (保留两位小数),
(保留两位小数),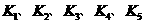 之间的关系为_____________________(用“>”、“<”或“=”连接);
之间的关系为_____________________(用“>”、“<”或“=”连接);
(3) 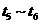 阶段保持容器内温度不变,若A的物质的量共变化了0.01mol,而此过程中容器与外界的热交换总量为
阶段保持容器内温度不变,若A的物质的量共变化了0.01mol,而此过程中容器与外界的热交换总量为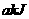 ,写出此温度下该反应的热化学方程式________________________________;
,写出此温度下该反应的热化学方程式________________________________;
23. (12分)下图表示不同温度(T)和压强(P)对可逆反应 2M(g)+N(g) 2L(g)
(12分)下图表示不同温度(T)和压强(P)对可逆反应 2M(g)+N(g) 2L(g)
影响情况,已知P2>P1,回答:
(1)图中纵轴表示的意义可能是( )
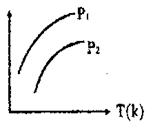 ①一定条件下M的转化率
①一定条件下M的转化率
②混合气体中M的体积百分含量
③混合气体中L的体积百分含量
④混合气体中的平均相对分子质量
⑤混合气体中的密度
(2)由上判断该反应的△H _______(>、<、=)0
(3)恒压(1.01×105Pa)下,将2molM与a molN的混合气体通入一个容积可变的密闭
容器中,发生反应。
①T1℃下反应达平衡时,测得容器内L、N的物质的量分别为1.3mol、3mol,则
a = ;平衡时M的转化率为
②T2℃下反应达平衡时,混合气体的物质的量共为4.8mol。T1与T2的关系是
(选填序号)。
A.T1 > T2 Y.T1 < T2 C.T1 = T2
(4)体积相同的甲、乙两个容器中,分别充有2molM与1 molN,在相同温度下发生反应并达到平衡。在这一过程中,甲容器保持体积不变化,乙容器保持压强不变,则达到平衡需要的时间甲________(>、<、=)乙
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com