
题目列表(包括答案和解析)
7下列溶液一定现中性的是( )
A、PH=7的溶液 B、c(H+)=10-7mol/L的溶液
C、c(H+)= c(OH-)=3.5×10-7mol/L的溶液 D、酸碱恰好完全中和的溶液
8. 下列操作中,能使电离平衡H2O H++OH-,向右移动且溶液呈酸性的是( )
H++OH-,向右移动且溶液呈酸性的是( )
A.向水中加入NaHSO4溶液 B.向水中加入Al2(SO4)3固体
C.向水中加入Na2CO3溶液 D.将水加热到100℃,使pH=6
33.(15分)某实验小组拟用酸碱中和滴定法测定食醋的总酸量(g/100mL),现邀请你参与本实验并回答相关问题。(有关实验药品为:市售食用白醋样品500mL、0.1000mol / LNaOH标准溶液、蒸馏水、0.1%甲基橙溶液、0.1%酚酞溶液、0.1%石蕊溶液。)
Ⅰ.实验步骤:
⑴用滴定管吸取10mL市售白醋样品,置于100mL容量瓶中,加蒸馏水(煮沸除去CO2并迅速冷却))稀释至刻度线,摇匀即得待测食醋溶液。
⑵用酸式滴定管取待测食醋溶液20.00mL于 中。
⑶盛装标准NaOH溶液,静置后,读取数据,记录为NaOH标准溶液体积的初读数。
 ⑷滴定,并记录NaOH的终读数。重复滴定2-3次。
⑷滴定,并记录NaOH的终读数。重复滴定2-3次。
Ⅱ.实验记录及数据处理
|
滴定次数 实验数据 |
1 |
2 |
3 |
4 |
|
V(样品)/mL |
20.00 |
20.00 |
20.00 |
20.00 |
|
V(NaOH)/mL(初读数) |
0.00 |
0.200 |
0.10 |
0.00 |
|
V(NaOH)/mL(终读数) |
14.98 |
15.20 |
15.12 |
15.95 |
|
V(NaOH)/mL(消耗) |
14.98 |
15.00 |
15.02 |
15.95 |
回答下面的问题
①步骤(2)使用到的仪器名称为:
②下列可用于测定溶液pH且精确度最高的是 ( )
(A)酸碱指示剂 (B)pH计 (C)精密pH试纸 (D)广泛pH试纸
③若用标准盐酸溶液滴定NaOH溶液时,由滴定前仰视读数,滴定结束时俯视读数,这样使求得的NaOH的物质的量浓度 ( )
A.偏低 B.偏高 C.偏低或偏高或不能确定 D.不受影响
④在酸碱中和滴定法测定食醋的总酸量的实验中根据上面的实验数据
则c(样品)/ moL·L-1= ;样品总酸量g / 100mL= 。
广东省清远一中09-10学年高二12月月考
32.(19分)某二元酸(化学式用H2B表示)在水中的电离方程式是:
H2B  H+ + HB– HB–
H+ + HB– HB– H+ + B2–
H+ + B2–
回答下列问题:
(1)Na2B溶液显_______(填“酸性”,“中性”,或“碱性”)。理由是
______________________________________(用离子方程式表示)(4分)。
(2)在0.1 mol/L的Na2B溶液中,下列粒子浓度关系式正确的是_________________。
A.c (B2– ) + c (HB– ) + c (H2B) = 0.1 mol/L
B.c (Na+ ) + c (OH– ) = c (H+) + c (HB– )
C.c (Na+ ) + c (H+ ) = c (OH – ) + c (HB– ) + 2c (B2 – )
D.c (Na+ ) = 2c (B 2– ) + 2c (HB– )
(3)已知0.1 mol/L NaHB溶液的pH = 2,则0.1 mol/LH2B溶液中氢离子的物质的量浓度可能是_________0.11 mol/L(填“<”,“>”,或“=”),理由是:
____________________________________________________________________。
(4)0.1 mol/L NaHB溶液中各种离子浓度由大到小的顺序是_______________________。
31.(本题18分)
恒温下,将a mol N2与b mol H2的混合气体通入一个固定容积的密闭容器中,发生如下反应:
N2(g)+3H2(g) 2NH3(g)
2NH3(g)
(1)若反应进行到某时刻t时,nt(N2)=13 mol,nt(NH3)=6 mol,计算a的值。
(2)反应达平衡时,混合气体的体积为716.8 L(标况下),其中NH3的含量(体积分数)为25%。计算平衡时NH3的物质的量。
(3)原混合气体与平衡混合气体的总物质的量之比(写出最简整数比,下同),n(始)∶n(平)=___________。
(4)原混合气体中,a∶b=_________________。
(5)达到平衡时,N2和H2的转化率之比,α(N2)∶α(H2)=________。
(6)平衡混合气体中,n(N2)∶n(H2)∶n(NH3)=___________。
30.(12分)在下列事实中,什么因素影响化学反应的速率?
⑴集气瓶中氢气和氯气的混合气体,在瓶外点燃镁条时发生爆炸。
⑵工业上常将固体燃料粉碎进行燃烧。
⑶熔化的氯酸钾放出气泡很慢,撒入少量MnO2很快产生气体。
⑷同浓度.同体积的盐酸中放入同样大小的锌粒和镁条,产生气体有快有慢。
 ⑸同样大小的石灰石分别在0.1mol·L-1的盐酸和1mol·L-1的盐酸中,
⑸同样大小的石灰石分别在0.1mol·L-1的盐酸和1mol·L-1的盐酸中,
产生气泡的速率不同。
⑹夏天的食品易霉变,冬天就不易发生该现象。
23. 如图是恒温下某化学反应的反应速率随反应时间变化的示意图,下列叙述与示意图不相符合的是
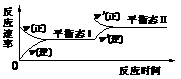
A.反应达平衡时,正反应速率和逆反应速率相等
B.该反应达到平衡态I后,增大反应物浓度,平衡发生移动,达到平衡态II
C.该反应达到平衡态I后,减小反应物浓度,平衡发生移动,达到平衡态II
D.同一种反应物在平衡态I和平衡态II时浓度相等
22.氢氰酸(HCN)的下列性质中,可以证明它是弱电解质的是
A. 1mol/L甲酸溶液的pH约为3 B. HCN易溶于水
C. 10 mL1mol/LHCN恰好与10 mL 1mol/L NaOH溶液完全反应
D. 在相同条件下,HCN溶液的导电性比强酸溶液的弱
12.某学生的实验报告所列出的下列数据中合理的是
A.用10mL量筒量取7.13mL稀盐酸
B.用托盘天平称量25.20g NaCl
C.用广泛pH试纸测得某溶液的pH为2.3
D.用25mL滴定管做中和滴定时,用去某浓度的碱溶液21.70mL
11. 把三氯化铁溶液蒸干灼烧,最后得到的固体产物是
A.无水三氯化铁 B.氢氧化铁 C. 氧化亚铁 D.三氧化二铁
10.在25℃时将pH=11 的NaOH 溶液与pH=3 的CH3COOH溶液等体积混合后,下列关系式中正确的是
a+)=c(CH3COO-)+c(CH3COOH) B.c(H+)=c(CH3COO-)+c(OH一)
a+) > c (CH3COO-)>c(OH-)>c(H+) D.c (CH3COO-)>c(Na+)>c(H+)>c(OH-)
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com