
题目列表(包括答案和解析)
33. (18分)今有氢氧化钠和碳酸钠混合溶液100 mL,为了测定此混合溶液中各物质的质量,用滴定管进行下列实验:
(18分)今有氢氧化钠和碳酸钠混合溶液100 mL,为了测定此混合溶液中各物质的质量,用滴定管进行下列实验:
 (1) 在用0.10 mol / L标准盐酸溶液润洗后的酸式滴定管中注入0.10 mol / L的标准盐酸溶液,调节滴定管的尖嘴部分___________,并记下管内液面所在刻度为2.23 mL。
(1) 在用0.10 mol / L标准盐酸溶液润洗后的酸式滴定管中注入0.10 mol / L的标准盐酸溶液,调节滴定管的尖嘴部分___________,并记下管内液面所在刻度为2.23 mL。
(2) 用___________取混合溶液20.00 mL注入200 mL的___________中,加入几滴酚酞试液(变色范围为8.2─10.0),振荡均匀后,把容器放在滴定管下,并在容器下面放一张白纸,其作用是______________________________________。
(3) 向容器中小心地滴入盐酸(边滴边振荡),直至因加入一滴酸后容器内液体由红色恰好变为无色时为止,记下滴定管液面所在刻度为27.74 mL。至此溶液中发生了如下变化:
NaOH+HCl=NaCl+H2O
Na2CO3+HCl=NaHCO3+NaCl
再向容器中滴入几滴甲基橙(变色范围pH为3.1─4.4),振荡,使溶液充分混合,这时溶液呈______色,小心地再向溶液中滴入标准盐酸直至因加入一滴酸后溶液颜色变为________色即为终点,记下滴定管液面所在刻度为35.40 mL,此溶液中又发生了如下反应:
NaHCO3+HCl=NaCl+H2O+CO2↑
(4) 由以上实验结果计算出:在1 L原试液中含氢氧化钠_______g;含碳酸钠______g。
广东省清远市连州中学09-10学年高二12月月考
32.(19分)25°时,将0.01molCH3COONa和0.002molHCl溶于水,形成1L混合溶液:
(1)该溶液中存在三个平衡体系,用电离方程式或离子方程式表示:
①________________________;
②________________________;
③________________________。
(2)溶液中共有___种不同的粒子(指分子或离子)。
(3)在这些粒子中,浓度为0.01mol/L的是__,浓度为0.002mol/L的是__。
(4)__和__两种粒子物质的量之和等于0.01mol。
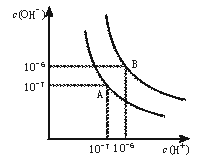
31.(9分)水的电离平衡曲线如下图所示。
(1)若以A点表示25℃时水在电离平衡时的离子浓度, 当温度升到100℃时,水的电离平衡状态到B点,则此时水的离子积从 增加到 。
(2)将常温下的pH=8的Ba(OH)2溶液与常温下的pH=5的稀盐酸混合,并保持100℃的恒温,欲使混合溶液pH=7,则Ba(OH)2与盐酸的体积比为 。
(3)已知AnBm的离子积=[c(Am+)]n·[c(Bn-)]m?,式中c(Am+)n和c(Bn-)m表示离子的物质的量浓度。在某温度下,Ca(OH)2的溶解度为0.74 g,其饱和溶液密度设为1 g/mL,其离子积为 。
30.(18分)
(1)AgNO3的水溶液呈 (填“酸”、“中”、“碱”)性,常温时的pH 7(填“>”、“=”、“<”),原因是(用离子方程式表示): ;实验室在配制AgNO3的溶液时,常将AgNO3固体先溶于较浓的硝酸中,然后再用蒸馏水稀释到所需的浓度,以 (填“促进”、“抑制”)其水解。
(2)氯化铁水溶液呈 性 ,原因是(用离子方程式表示):
_____________________ _____________________________ 。把FeCl3溶液蒸干,灼烧,最后得到的主要固体产物是 。
 (3)在配制氯化铁溶液时,为了防止发生水解,可以加入少量的 。
(3)在配制氯化铁溶液时,为了防止发生水解,可以加入少量的 。
20. .某氨水的pH=X,某盐酸的pH=Y,已知X+Y=14,将上述氨水与盐酸等体积混合后,所得溶液中各种离子浓度的关系正确的是 ( )
A. c( )>c(Cl-)>c(OH-)>c(H+) B. c(
)>c(Cl-)>c(OH-)>c(H+) B. c( )>c(Cl-)>c(H+)>c(OH-)
)>c(Cl-)>c(H+)>c(OH-)
C. c(Cl-)>c( )>c(H+)>c(OH-) D. c(
)>c(H+)>c(OH-) D. c( )+c(H+)=c(Cl-)+c(OH-)
)+c(H+)=c(Cl-)+c(OH-)

19.氢氰酸(HCN)的下列性质中,可以证明它是弱电解质的是
A. 1mol/L甲酸溶液的pH约为3
B. HCN易溶于水
C. 10 mL1mol/LHCN恰好与10 mL 1mol/L NaOH溶液完全反应
D. 在相同条件下,HCN溶液的导电性比强酸溶液的弱
12.向等体积、pH=2的两种一元酸HA和HB的溶液中加入足量的镁粉,充分反应后,收集到H2的体积V(HA)> V(HB),下列说法正确的是
(A)HA一定是弱酸
(B)HB一定是强酸
(C)NaA溶液的碱性弱于NaB溶液的碱性
(D)反应开始时二者生成H2的速率相同
11.室温下,pH相同,体积相同的醋酸和盐酸两种溶液分别采取下列措施,有关叙述正确的是
(A)加水稀释2倍后,两溶液的pH均减小
(B)使温度都升高20℃后,两溶液的pH均不变
(C)加适量的醋酸钠晶体后,两溶液的pH均增大
(D)加足量的锌充分反应后,醋酸产生的氢气比盐酸多
10.下列各方程式中,属于水解反应的是 ( )
A. 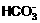 +H2O
+H2O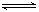 H2CO3+OH- B.
H2CO3+OH- B. 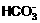 +H2O
+H2O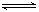
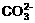 +H3O+
+H3O+
C. 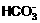 +OH-
+OH-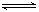
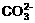 +H2O D.
+H2O D. 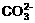 +H+=
+H+=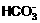
9. PH=13的强碱溶液与pH=2的强酸溶液混合,所得溶液的pH=11,则强碱与强酸的体积比是
A 11:1 B 9:1 C 1:11 D 1:9
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com