
题目列表(包括答案和解析)
21.(4分)元素周期表中前20号元素的第一电离能如图所示。试根据元素在周期表中的位置,分析表中曲线的变化特点,并回答下列问题。
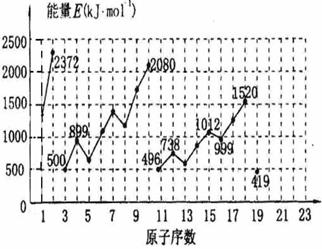
(1)同主族内不同元素的第一电离能变化的特点是
。
(2)同周期内,随原子序数增大,第一电离能增大。但个别元素的第一电离能出现反常现象,请分析其反常现象与原子结构的关系,预测下列关系式中正确的是 (填写编号)
① E(砷) > E(硒) ② E(砷)< E(硒)
③ E(溴) > E(硒) ④ E(溴)< E(硒)
(3)估计Ca 原子的第一电离能[用E(Ca)表示]范围: < E(Ca)<
(4)10号元素第一电离能较大的原因是
20.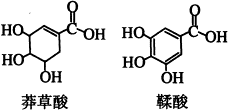 莽草酸是一种合成治疗禽流感药物达菲的原料,鞣酸存在于苹果、生石榴等植物中。下列关于这两种有机化合物的说法正确的是
莽草酸是一种合成治疗禽流感药物达菲的原料,鞣酸存在于苹果、生石榴等植物中。下列关于这两种有机化合物的说法正确的是
A. 两种酸都能与溴水反应
B. 两种酸遇三氯化铁溶液都显紫色
C. 鞣酸分子与莽草酸分子相比多了两个碳碳双键
D. 等物质的量的两种酸与足量金属钠反应产生氢气的不同
 |
|||||||||||
|
|||||||||||
福建省厦门六中09-10学年高二上学期12月月考
化学试题
第Ⅱ卷(非选择题 共47分)
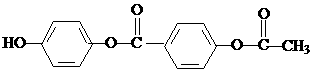
18. 1mol 与足量的NaOH
溶液充分反应,消耗的NaOH的物质的量为
A.5 mol B.4 mol C.3 mol D.2 mol
19.下列叙述错误的是
A.合金材料中可能含有非金属元素
B.人造纤维,合成纤维和光导纤维都是有机高分子化合物
C.加热能杀死流感病毒是因为病毒的蛋白质受热变性
D.在车排气管上加装“催化转化器”是为了减少有害气体的排放
17.用价层电子对互斥理论预测H2S和BF3的立体结构,两个结论都正确的是
A.直线形;三角锥形 B. V形;三角锥形
C.直线形;平面三角形 D. V形;平面三角形
16.根据等电子原理,等电子体之间结构相似。以下各组粒子不能互称为等电子体的是
A.CO和N2 B.O3 和SO2
C.CO2和N2O D.N2H4 和C2H4
15.下列分子中,所有原子的最外层均为8电子结构的是
A.BeCl2 B.H2S C.NCl3 D.PCl5
14.下列各组微粒,半径大小比较中错误的是
A.K >Na >Li B.Na+>Mg2+>Al3+
C.Mg2+>Na+>F- D.Cl->F->F
13. 下列微粒中,最外层未成对电子数最多的是
A. O B. P C. Mn D. Fe3+
12.下列不能根据元素电负性判断的是
A.判断一种元素是金属还是非金属
B. 判断化合物中元素正负价
C.判断化学键类型
D. 判断化合物溶解度
11.有关乙烯分子中的化学键描述正确的是
A.每个碳原子的sp2杂化轨道中的其中一个形成π键
B.每个碳原子的未参加杂化的2p轨道形成σ键
C.碳原子的三个sp2杂化轨道与其它原子形成三个σ键
D.碳原子的未参加杂化的2p轨道与其它原子形成σ键
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com