
题目列表(包括答案和解析)
5、下列物质中既能与盐酸反应,又能与NaOH溶液反应的是( )
①NaHCO3 ② (NH4)2CO3 ③Al(OH)3
④NH4Cl ⑤H2NCH2COOH ⑥CH3COOH
A.①②③ B.①②④⑤ C. ⑤⑥ D.①②③⑤
4、只用一种试剂就可以鉴别苯、碘化钾溶液、硝酸银溶液、己烯、四氯化碳,这种试剂是( )
A.NaOH溶液 B.KMnO4溶液 C.溴水 D.Na2CO3
3、下列说法不正确的是( )
A.共价化合物和离子化合物中,一定都含有非金属元素。
B.离子化合物中,一定既含有金属元素又含有非金属元素。
C.化学变化过程,一定会破坏旧的化学键,同时形成新的化学键。
D.所有化学反应都伴随着能量变化。
2、下列物质属于天然高分子化合物的是( )
A.聚乙烯 B.尼龙 C.油脂 D.纤维素
1、下列化学名词正确的是( )
A.溴笨 B.氨基酸 C.乙酸乙脂 D.氯化氨
23.(13分)下图表示有关物质(均由短周期元素形成)之间的转化关系,其中A为常见的金属单质,B为非金属单质(一般是黑色粉末),C是常见的无色无味液体,D是淡黄色的固体化合物(反应条件图中已省略)。
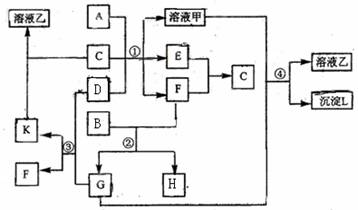
(1)A、D、F所代表物质的化学式分别为 、 、 。
(2)反应①中A恰好完全反应,C过量,写出该反应过程的所有化学方程式
。
(3)反应②中,若参加反应的B与F 的物质的量之比为3∶2,则生成的G与H物质的量之比为 。
(4)反应④的离子方程式是 。
(5)写出溶液乙与浓的氯化镁溶液混合时所发生反应的离子方程式
。
命题人:李盛森 郭丽
 2009年重庆一中高2011级月考
2009年重庆一中高2011级月考
22.(12分) 实验室常利用甲醛(HCHO)法测定(NH4)2SO4样品中氮元素的质量分数,其反应原理为:4NH4++6HCHO=3H++6H2O+(CH2)6N4H+,然后用NaOH标准溶液滴定反应生成的酸[滴定时,1mol (CH2)6N4H+与1mol H+相当]。某兴趣小组用甲醛法进行了如下实验:
步骤I:准确称取样品1.4 g。
步骤Ⅱ:将样品溶解后,完全转移到250
mL容量瓶中,定容,充分摇匀。
步骤Ⅲ:移取25.00 mL样品溶液于250 mL锥形瓶中,加入10 mL 20%的中性甲醛溶液(足量)并摇匀,静置5
min后加入1-2滴酚酞试液,用NaOH标准溶液滴定至终点。按上述操作方法再重复2次。
实验室常利用甲醛(HCHO)法测定(NH4)2SO4样品中氮元素的质量分数,其反应原理为:4NH4++6HCHO=3H++6H2O+(CH2)6N4H+,然后用NaOH标准溶液滴定反应生成的酸[滴定时,1mol (CH2)6N4H+与1mol H+相当]。某兴趣小组用甲醛法进行了如下实验:
步骤I:准确称取样品1.4 g。
步骤Ⅱ:将样品溶解后,完全转移到250
mL容量瓶中,定容,充分摇匀。
步骤Ⅲ:移取25.00 mL样品溶液于250 mL锥形瓶中,加入10 mL 20%的中性甲醛溶液(足量)并摇匀,静置5
min后加入1-2滴酚酞试液,用NaOH标准溶液滴定至终点。按上述操作方法再重复2次。
根据步骤Ⅲ填空:
(1)NaOH标准溶液应装在 (填“酸式”或“碱式”)滴定管。当滴定达到终点时,锥形瓶中溶液的颜色是 色。
(2)若所用滴定管的量程是25.00 mL,当管内凹液面最低处位于4.00 mL时,管内所装溶液的体积为 。
A.等于4.00 mL B.大于4.00 mL C.等于21.00 mL D.大于21.00 mL
(3)在滴定过程中应边滴边摇动锥形瓶,眼睛应注视 。 A.滴定管内液面的变化 B.锥形瓶内溶液颜色的变化 C.锥形瓶内溶液体积的变化 D.液体的滴速
(4)滴定结果如下表所示:
|
滴定次数 |
待测溶液的体积/mL |
标准溶液的体积 |
|
|
滴定前刻度/mL |
滴定后刻度/mL |
||
|
1 |
25.00 |
1.02 |
21.03 |
|
2 |
25.00 |
2.00 |
21.99 |
|
3 |
25.00 |
0.20 |
20.20 |
若NaOH标准溶液的浓度为0.1 mol/L,则该样品中氮元素的质量分数为 。
(5)下列操作可能会使测得的结果偏高的是 。
A.碱式滴定管用蒸馏水洗涤后,直接加入NaOH标准溶液进行滴定 B.锥形瓶用蒸馏水洗涤后,未用待装溶液润洗
C.滴定前碱式滴定管的尖嘴处有气泡,滴定后消失
D.滴定完成后仰视读数
E.终点时颜色发生变化后立即读数
21.(10分)某厂的酸性工业废水中含有一定量的Fe3+、Cu2+、Au3+等离子。有人设计了图中的工艺流程,利用常用的强酸、强碱和工业生产中的废铁屑,从废水中回收金,并生产一定量的铁红和氧化铜。

填写下面空白:
(1)图中标号处需加入的相应物质的名称分别是① 、② 、 ③ 、④ 。
(2)写出上述流程中与Au3+有关的离子方程式 。
(3)写出③处发生反应的化学方程式 。
(4)写出铁红与足量HI溶液反应的离子方程式 。
20.(10分)明矾在常温下是一种无色透明的晶体,它是医学上的常用药物,可用于治疗高血脂、溃疡等病症。明矾在其它领域也有着广泛应用。
(1)明矾的化学式是 。
(2)明矾可用作净水剂,用一个离子方程式表示其原理 。
(3)泡沫灭火器内所装的溶液可以选择明矾溶液和NaHCO3溶液,写出这两种溶液混合时所发生反应的离子方程式 。
(4)向明矾溶液中逐滴滴加Ba(OH)2溶液至产生沉淀的质量达到最大值,用一个离子方程式表示该过程发生的反应 。
(5)向 50 mL 1 mol/L明矾溶液中加入一定体积1.5 mol/L NaOH溶液,充分反应后产生 1.56 g沉淀,则加入NaOH溶液的体积可能为 mL。
19.(11分)硫酸被人们誉为“化学工业之母”,在国民生产中发挥着重要作用,硫酸的产量是衡量一个国家化学工业水平的标志。工业上生产硫酸包括三步:
(1)第一步,在沸腾炉中煅烧黄铁矿,反应如下:4FeS2+11O2 8SO2+2Fe2O3,该反应的氧化产物是
,当生成8 mol SO2时转移电子的物质的量为 。
8SO2+2Fe2O3,该反应的氧化产物是
,当生成8 mol SO2时转移电子的物质的量为 。
(2)第二步,在接触室中发生如下反应:2SO2+O2 2SO3。某科技小组的同学在一个恒温恒容的容器中模拟该反应,他们分两次进行实验,第一次向容器中加入2 mol SO2、1 mol O2,反应达平衡后测得SO2的转化率为α1,第二次向容器中加入3 mol SO2、1.5 mol O2,
反应达平衡后测得SO2的转化率为α2,则α1 α2(填“大于”、“等于”或“小于”)。
2SO3。某科技小组的同学在一个恒温恒容的容器中模拟该反应,他们分两次进行实验,第一次向容器中加入2 mol SO2、1 mol O2,反应达平衡后测得SO2的转化率为α1,第二次向容器中加入3 mol SO2、1.5 mol O2,
反应达平衡后测得SO2的转化率为α2,则α1 α2(填“大于”、“等于”或“小于”)。
(3)第三步,在吸收塔中将SO3转化成硫酸。硫酸是化学实验中的常用试剂:
①有Na、Mg、Al、Cu四种金属,若两两混合后取混合物14 g与足量稀硫酸反应,产生标准状况下H2 5.6 L,则此混和物的组合方式最多有 种。
②可用稀硫酸与FeS反应来制H2S,H2S的水溶液叫做氢硫酸,它是一种二元弱酸。现将0.1 mol/L H2S溶液与0.2 mol/L NaOH溶液等体积混合,所得混合液中的关系正确的是 。
A.c(Na+)+c(H+)=c(HS-)+c(OH-)+2c(S2-) B. c(H2S) +c(HS-) +c(S2-) =0.1 mol·L-1 C.2 c(H2S) +c(HS-) + c(H+) = c(OH-) D.c(Na+)=2 c(H2S) +2c(HS-) +2c(S2-)
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com