
题目列表(包括答案和解析)
16. 在密闭容器中发生反应2SO2+O2
2SO3(g),起始时SO2和O2分别为20mol和10mol,
在密闭容器中发生反应2SO2+O2
2SO3(g),起始时SO2和O2分别为20mol和10mol,
达到平衡时,SO2的转化率为80%。若从SO3开始进行反应,在相同的条件下,欲使平衡时各成分的体积分数与前者相同,则起始时SO3的物质的量及SO3的转化率分别为
( )
A.10mol和10% B.20mol和20%
C.20mol和40% D.30mol和80%
15.一定量的盐酸跟过量的铁粉反应时,为了减缓反应速率,且不影响生成氢气的总量,可向盐酸中加入适量的 ( )
A.NaOH(固体) B.H2O C.NaCl(固体) D.CH3COONa(固体)
14.室温时下列混合溶液的pH一定小于7的是
A.pH=3的盐酸和pH=11的氨水等体积混合
B.pH=3的盐酸和pH=11的氢氧化钡等体积混合
C.pH=3的醋酸和pH=11的氢氧化钡等体积混合
D.pH=3的硫酸和pH=11的氨水等体积混合
13. mA+nB pC+qD,该反应在其它条件不变的情况下,以T1和T2表示不同温度,I表示T1时的平衡状态,II表示T2的平衡状态,则下列叙述符合图2所示的是( )(B%为B的体积分数)
mA+nB pC+qD,该反应在其它条件不变的情况下,以T1和T2表示不同温度,I表示T1时的平衡状态,II表示T2的平衡状态,则下列叙述符合图2所示的是( )(B%为B的体积分数)
A.正反应是吸热反应 B.T1>T2
C.逆反应是吸热反应 D.T2>T1
12.氢氧燃料电池是将H2和O2分别通入电池,穿过浸入20%-40%的KOH溶液的多孔碳电极,其电极反应式为H2+2OH--2e- 2H2O和
2H2O和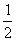 O2+H2O+2e-
O2+H2O+2e- 2OH-,则下列叙述正确的是( )
2OH-,则下列叙述正确的是( )
A.通入H2的一极是正极,通入O2的一极是负极
B.通入O2的一极是正极,通入H2的一极是负极
C.工作一段时间后电解质溶液的pH增大
D.工作时负极区附近pH增大
11.若溶液中由水电离产生的c(H+)=1×10-14mol/L,满足此条件的溶液中一定可以大量共存的离子组是 ( )
A.Al3+、Na+、NO 、Cl- B.K+、Na+、Cl-、NO
、Cl- B.K+、Na+、Cl-、NO
C.K+、Na+、Cl-、S2- D.K+、NH 、SO
、SO 、NO
、NO
10. 一定条件下,在2SO2+O2 2SO3的化学平衡体系中,各物质的浓度分别是:SO2:2mol/L,O2 :
0.8mol/L,SO3 : 2.4mol/L,则氧气在起始时的浓度可能是 ( )
一定条件下,在2SO2+O2 2SO3的化学平衡体系中,各物质的浓度分别是:SO2:2mol/L,O2 :
0.8mol/L,SO3 : 2.4mol/L,则氧气在起始时的浓度可能是 ( )
A.0.8-2mol/L B.0-2mol/L C.0-0.8mol/L D.无法确定
9.已知:C(s)+CO2(g) 2CO(g) △H>0。该反应达到平衡后,下列条件有利于反应向正方向进行的是 ( )
2CO(g) △H>0。该反应达到平衡后,下列条件有利于反应向正方向进行的是 ( )
A.升高温度和减小压强 B.降低温度和减小压强
C.降低温度和增大压强 D.升高温度和增大压强
7. 在恒温、恒容的条件下,有反应2A(g)+2B(g)
C(g)+3D(g),现从两条途径分别建立平衡。途径I:A、B的起始浓度为2mol·L-1;途径II:C、D的起始浓度分别为2mol·L-和6mol·L-;则以下叙述正确的是 ( )
在恒温、恒容的条件下,有反应2A(g)+2B(g)
C(g)+3D(g),现从两条途径分别建立平衡。途径I:A、B的起始浓度为2mol·L-1;途径II:C、D的起始浓度分别为2mol·L-和6mol·L-;则以下叙述正确的是 ( )
A.两途径最终到平衡时,体系内混合气的百分组成相同
B.两途径最终达到平衡时,体系内混合气的百分组成不同
C.达平衡时,途径I的反应速率v(A)等于途径II的反应速率v(A)
D.达平衡时,途径I所得混合气的密度为途径II所得混合气密度的1/2

 8.如图1所示,可逆反应:mA(g)+nB(g) xC(g),在不同温度、压强下反应物A的转化率的变化情况。下列对于反应的热效应和反应方程式中A、B、C的系数的判断中,正确的是 ( )
8.如图1所示,可逆反应:mA(g)+nB(g) xC(g),在不同温度、压强下反应物A的转化率的变化情况。下列对于反应的热效应和反应方程式中A、B、C的系数的判断中,正确的是 ( )
A.放热,m+n>x
B.放热,m+n<x
C.吸热,m+n<x
D.吸热,m+n>x
6.一定条件下,体积为10L的密闭容器中,1molX和1molY进行反应:
2X(g)+Y(g)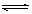 Z(g),经60s达到平衡,生成0.3molZ。下列说法正确的是 ( )
Z(g),经60s达到平衡,生成0.3molZ。下列说法正确的是 ( )
A.以X浓度变化表示的反应速率为0.001mol/(L·S)
B.将容器体积变为20L,Z的平衡浓度变为原来的
C.若增大压强,则物质Y的转化率减小
D.若升高温度,X的体积分数增大,则该反应的△H>0
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com