
题目列表(包括答案和解析)
16.物质在水中可能存在电离平衡、盐的水解平衡和沉淀的溶解平衡,它们都可看作化学平衡。请根据所学知识的回答:
(1)A为0.1 mol·L-1的(NH4)2SO4溶液,在该溶液中各种离子的浓度由大到小顺序为
。
(2)B为0.1 mol·L-1NaHCO3溶液,在NaHCO3溶液中存在的各种平衡体系为(用离子方程式表示): ;
 实验测得NaHCO3溶液的pH > 7,请分析NaHCO3溶液显碱性的原因:
实验测得NaHCO3溶液的pH > 7,请分析NaHCO3溶液显碱性的原因:
。
(3)C为FeCl3溶液,实验室中配制FeCl3溶液时通常需要向其中加入 ,目的是 ;
若把B和C溶液混合,将产生红褐色沉淀和无色气体,该反应的离子方程式为
。
(4)D为含有足量AgCl固体的饱和溶液,氯化银在水中存在沉淀溶解平衡:
 AgCl(S) Ag+(aq)+ Cl-(aq) 在25℃时,氯化银的Ksp =
1.8×10-10
AgCl(S) Ag+(aq)+ Cl-(aq) 在25℃时,氯化银的Ksp =
1.8×10-10
25℃时,现将足量氯化银分别放入:①100mL蒸馏水中;②100mL 0.2 mol·L-1AgNO3溶液中;③100mL 0.1 mol·L-1氯化铝溶液中;④100mL 0.1 mol·L-1盐酸溶液中。充分搅抖后,相同温度下银离子浓度由大到小的顺序是 (填写序号);②中氯离子的浓度为 mol·L-1。
15.某学生用0.1000 mol·L-1标准氢氧化钠溶液滴定未知浓度的盐酸溶液,其操作可分解为如下几步:
A.取20.00 mL待测盐酸溶液注入洁净的锥形瓶中,并加入2-3滴酚酞试液
B.用标准氢氧化钠溶液润洗滴定管2-3次
 C.把盛有标准氢氧化钠溶液的碱式滴定管固定好,调节滴定管尖嘴使之充满溶液
C.把盛有标准氢氧化钠溶液的碱式滴定管固定好,调节滴定管尖嘴使之充满溶液
D.取标准氢氧化钠溶液注入碱式滴定管至“0”刻度以上2-3mL处
E.调节液面至“0”或“0”刻度以下,记下读数,为3.10mL
|
回答下列问题:
(1)正确的操作顺序是:B、 、F(填序号);
(2)上述B步骤操作的目的是 ;
(3)上述A步骤操作之前,若先用待测溶液润洗锥形瓶,则对滴定结果的影响
是 (填“偏大”或“偏小”或“无影响”);
(4)判断到达滴定终点的实验现象是 ;
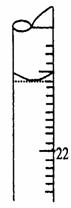
(5)若滴定结束时,滴定管液面如图所示,则终点读数为 mL。
(6)根据读数计算出该待测液的浓度为 。
14、二元酸H2A在水中发生电离:H2A=H++HA-和HA- H++A2-,则下列几种物质的水溶液中关系式不正确的是
H++A2-,则下列几种物质的水溶液中关系式不正确的是
A.NaHA:c(Na+)>c(HA-)>c(OH-)>c(H+)
B.NaHA:c(Na+)=c(A2-)+c(HA-)
C.Na2A:c(Na+)>c(A2-) >c(OH-)>c(H+)
 D.H2A:c(H+)=c(HA-)+2 c(A2-)+c(OH-)
D.H2A:c(H+)=c(HA-)+2 c(A2-)+c(OH-)
选择题答题栏:
第Ⅱ卷 (共44分)
13.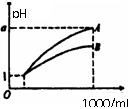 pH=1的两种酸溶液A、B各1mL,分别加水稀释到1000mL,其pH与溶液体积(V)的关系如图示,下列说法不正确的是
pH=1的两种酸溶液A、B各1mL,分别加水稀释到1000mL,其pH与溶液体积(V)的关系如图示,下列说法不正确的是
A.稀释后,A酸溶液的酸性比B酸溶液弱
B.若a=4,则A是强酸,B是弱酸
C.若1<a<4,则A、B都是弱酸
D.A、B两种酸溶液的物质的量浓度相等
12.某化学兴趣小组同学探索某些溶液的酸碱性。25℃时他们分别测得CH3COOH和(NH4)2SO4两种溶液的pH都为4,并对结果作了以下四种分析。则其中正确的是
A.(NH4)2SO4溶液呈酸性是因为NH4+电离出H+
B.因为醋酸是弱酸,所以醋酸溶液中水的电离平衡被促进了
C.CH3COOH和(NH4)2SO4溶液中水的电离出来的H+的物质的量浓度相同
D.CH3COOH和(NH4)2SO4两水溶液呈酸性的原因不同
11. 下列关于弱电解质的说法正确的是:
A. 弱电解质的相对强弱可由相同温度下的电离常数值的大小来判断。
B. 同一弱电解质,浓度越大,电离度越大。
C. 升高温度,弱电解质的电离程度减小。
D. 电解质越弱,则其的溶液导电能力就越差。
10.室温时,将x mL pH=a 的稀NaOH溶液与ymL pH=b的稀盐酸充分反应。下列关于反应后溶液pH的判断,正确的是
A.若x=y,且a+b=14,则pH>7 B.若10x=y,且a+b=13,则pH=7
C.若ax=by,且a+b=13,则pH=7 D.若x=10y,且a+b=14,则pH>7
9. 温度相同、浓度均为0.2 mol的①(NH4)2SO4、②NaNO3、③NH4HSO4、④NH4NO3、
⑤苯酚钠⑥CH3COONa溶液,它们的pH值由小到大的排列顺序是
A. ③①④②⑥⑤ B. ③①⑥④②⑤
C. ③②①⑥④⑤ D. ⑤⑥②④①③
8.下列关于电解质溶液的叙述正确的是
A.常温下,pH=7的NH4Cl与氨水的混合溶液中离子浓度大小顺序为
 c(Cl-)>c(NH4+)>c(H+)>c(OH-)
c(Cl-)>c(NH4+)>c(H+)>c(OH-)
B.将pH=4的醋酸溶液稀释后,溶液中所有离子的浓度均降低
C.中和pH与体积均相同的盐酸和醋酸溶液,消耗NaOH的物质的量相同
D.常温下,同浓度的Na2S与NaHS溶液相比,Na2S溶液的pH大
7.一定能在下列溶液中大量共存的离子组是
A.水电离产生的c(H+)=1×10-12mol/L溶液:NH4+、Na+、Cl-、NO3-
B.能使pH试纸变深蓝色的溶液中:Na+、AlO2-、S2-、CO32-
C.含有大量Fe3+的溶液:SCN-、I-、K+、Br-
D.酸性溶液中:Cl-、MnO4-、Al3+、SO42-
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com