
题目列表(包括答案和解析)
1、分子式: 结构式: 存在: 、 、
化石燃料: 、 、
天然气的主要成分:
石油的组成元素主要是 和 ,同时还含有S、O、N等。主要成分各种液态的碳氢化合物,还溶有气态和固态的碳氢化合物
煤是有机化合物和无机化合物所组成的复杂的混合物。煤的含量是 , 其次H、O
24.(10分)城市使用的燃料,现大多用煤气、液化石油气。煤气的主要成分是CO和H2的混合气体,它是由煤炭和水蒸气在高温下反应制得,故又称水煤气。
(1)试写出制取水煤气的主要化学方程式___________________________________;
(2)液化石油气的主要成分是丙烷,丙烷燃烧的热化学方程式为
C3H8(g)
+5O2(g) == 3CO2(g)
+ 4H2O(l);△H=-2220.0 kJ· ,又知CO气体燃烧的热化学方程式为:CO(g) +1/2O2(g) == CO2(g) ;△H=-282.57kJ·
,又知CO气体燃烧的热化学方程式为:CO(g) +1/2O2(g) == CO2(g) ;△H=-282.57kJ· ,试比较同物质的量的C3H8和CO燃烧,产生的热量比值约为________;(保留两位小数)
,试比较同物质的量的C3H8和CO燃烧,产生的热量比值约为________;(保留两位小数)
(3)已知氢气燃烧的热化学方程式为2H2(g)+O2(g) == 2H2O(l);△H=–571.6 kJ· ,试比较同质量的H2和C3H8燃烧,产生的热量比值约为________________ ;(保留两位小数)
,试比较同质量的H2和C3H8燃烧,产生的热量比值约为________________ ;(保留两位小数)
(4)氢气是未来的能源,除产生的热量大之外,还具有的优点是________________。
23.(8分)已知H2的燃烧热为-285.8 kJ·mol-1,CO的燃烧热为-283.0 kJ·mol-1,甲醇(CH3OH)的燃烧热为-726.5 kJ·mol-1 。请通过计算写出由CO和H2合成甲醇的热化学方程式。
22.(12分)工业上由金红石(TiO2)制取单质Ti,涉及的步骤为:
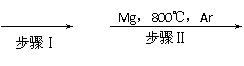
TiO2 TiCl4 Ti
(1)写出步骤ⅡTiCl4→Ti的化学方程式 。
(2)已知:①
②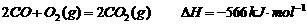
③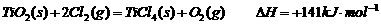
则反应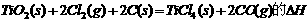 =
kJ·mol-1
=
kJ·mol-1
21.(6分)火箭推进器中盛有强还原剂液态肼(N2H4)和强氧化剂液态双氧水(H2O2),当它们混合反应时,即产生大量氮气和水蒸气,并放出大量热。已知0.1mol液态肼与组量液态双氧水反应时,放出64kJ的热量。请写出该反应的热化学方程式:
20.(11分)一些原子序数较小的金属、非金属和常用燃料的单位质量燃烧热的比较如下图所示[肼(N2H4)和硼烷(B5H9)为传统火箭燃料]。
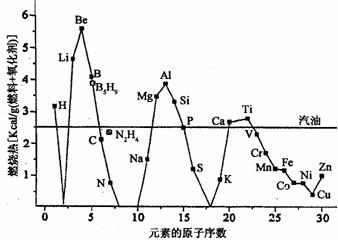
请回答下列问题:
(1)结合元素在地壳中的含量,在单位质量燃烧热大于汽油和氢单质的物质中,最具发展潜力的两种新型燃料可以是________________(填写元素符号)。这些物质作为燃料使用,除具有高燃烧热值外,还具有的优点是__________________________(填一项)。
(2)制成纳米、微米级的颗粒不仅降低了金属燃料的燃点,也使得燃烧更为容易和充分,其原因是__________________________________
(3)Al粉和Cr2O3粉末在高温下可以反应,请写出反应的化学方程式
_______________________________________________________;
根据图示推测可能的原因是_____________________________________________
19.(8分)已知下列两个热化学方程式;
H2(g)+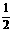 O2(g)==H2O(1) △H = -285.8 kJ·mol-1
O2(g)==H2O(1) △H = -285.8 kJ·mol-1
C3H8(g)+5O2(g)==3CO2(g)+4H2O(1) △H = -2220.0 kJ·mol-1l
(1)实验测得H2和C3H8的混合气体共5mol,完全燃烧生成液态水时放热6264.5kJ,则混合气体中H2和C3H8的体积比是 。
(2)已知:H2O(1)=H2O(g) △H = +44.0 kJ·mol-1,写出丙烷燃烧生成CO2和气态水的热化学方程式 。
18.含2-5个碳原子的直链烷烃沸点和燃烧热的数据见下表:
|
烷烃名称 |
乙烷 |
丙烷 |
丁烷 |
戊烷 |
|
沸点(℃) |
-88.6 |
-42.1 |
-0.5 |
36.1 |
|
燃烧热(kJ·mol-1) |
1560.7 |
2219.2 |
2877.6 |
3535.6 |
燃烧热:1摩尔物质完全燃烧,生成二氧化碳、液态水时所放出的热量。
根据表中数据,下列判断错误的是 ( )
A.己烷在常温常压下肯定不是气体
B.烷烃燃烧和其所含碳原子数成线性关系
C.随碳原子数增加,烷经沸点逐渐升高
D.随碳原子数增加,烷经沸点和燃烧都成比例增加
第Ⅱ卷 (非选择题 56分)
17.已知:①1 mol H2分子中化学键断裂时需要吸收436kJ的能量
②1 mol Cl2分子中化学键断裂时需要吸收243kJ的能量
③由H原子和Cl原子形成1 mol HCl分子时释放431kJ的能量
下列叙述正确的是 ( )
A.氢气和氯气反应生成氯化氢气体的热化学方程式是 H2(g) + Cl2(g) = 2HCl(g)
B.氢气和氯气反应生成2 mol氯化氢气体,反应的△H = 183 kJ·mol-1
C.氢气和氯气反应生成2 mol氯化氢气体,反应的△H =-183 kJ·mol-1
D.氢气和氯气反应生成1 mol氯化氢气体,反应的△H =-183 kJ·mol-1
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com