
题目列表(包括答案和解析)
第II卷 非选择题
27.(8分)有色物质溶液颜色的深浅与溶液中有色物质的浓度有一定关系,利用比较颜色深浅来测定溶液中某种组分含量的分析方法称比色分析法,可以是目视比色,或是利用分光光度计测试仪器,也可以采用传感器技术中的色度计。此类实验原理基于朗伯-比尔定律,简单地说就是在吸光物质的性质、入射光波长及温度等因素一定的情况下,溶液对光的吸收程度与吸光物质浓度及吸收层厚度成正比,颜色越深,吸光度越大。某化学兴趣小组用以下比色法测定反应Fe3++SCN- FeSCN2+的平衡常数。
FeSCN2+的平衡常数。
①取口径大小相同的干净试管2支,贴上标签A、B,分别加入0.0020mol/L的KSCN溶液5mL,并在A试管内加入0.20mol/L的Fe(NO3)3溶液5.0mL,将此混合液作为标准溶液(其中所有的SCN-离子几乎完全变成FeSCN2+)。
②另取0.20mol/L的Fe(NO3)3溶液10.0mL,加入蒸馏水稀释到总体积为25.0mL,充分混合,取稀释后的溶液5.0mL加入(1)中的B试管内。然后进行比色,测定其平衡常数值。请回答下列问题:
(1)未与KSCN反应前,B试管内Fe(NO3)3的物质的量浓度是多少?
(2)比色时,所见溶液的颜色深浅,随着管内溶液的高度与溶液的浓度而改变。欲调整A、B两试管溶液的色度直至相等,具体操作是用滴管从色度较深的A试管中,吸出部分溶液,放在干净的小烧杯中,然后再慢慢滴回A试管中,同时由试管口上方向下俯视,直至A、B试管所呈色度相等为止。测量两试管溶液的深度,得A试管为6.4cm,B试管为8cm,据此可求得B试管内FeSCN2+物质的量浓度是多少?
(3)求出此反应的平衡常数。
余姚中学 高二化学实验班第二次质量检测答题卷
|
 第I卷 选择题
第I卷 选择题26.(8分)在120℃,101kPa条件下,由H2、CH4、CO组成的混合气体a mL,通入一定量(设为x mL)氧气使其完全燃烧。
(1)若a mL混合气体完全燃烧消耗相同条件下氧气的体积也为a mL(即x=a),则原混合气体中CH4的体积分数是 。
(2)若完全燃烧后生成CO2和H2O(g)的总体积在相同条件下为2a mL,则原混合气体中CH4的体积分数是 ,现要测定原混合气体中H2的体积分数,还必须知道相同条件下其它数据可以是 (填选项字母)。
A.前面提供的数据已经足够 B.生成CO2气体的总体积
C.生成H2O(g)的总质量 D.2a mL混合气体的密度
(3)若原混合气体完全燃烧时,生成的气体中只有CO2和H2O(g),求x的取值范围 。
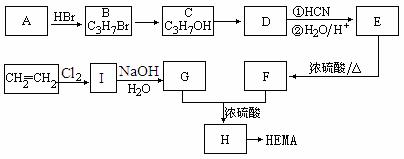
25.软性隐形眼镜可由聚甲基丙烯酸羟乙酯(HEMA)制成超薄镜片,其合成路线可以是:
已知⑴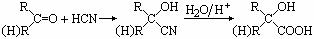
⑵CH3COOCH2CH2OH的名称为乙酸羟乙酯
试写出:
(1)A、E的结构简式分别为:A 、E 。
(2)写出下列反应的反应类型:C→D ,E→F 。
(3)写出下列转化的化学方程式:
I→G ;
G+F→H 。
24.人们能在昏暗的光线下看见物体离不开视网膜中一种叫视黄醛的物质。顺式视黄醛吸收光线后就转变为反式视黄醛,并从所在的蛋白质上脱离,这个过程产生的信号传递给大脑,我们就看见了物质。而顺式视黄醛需由反式视黄醛在视黄醛异构酶的作用下转化而来。

|
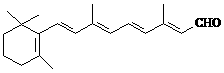
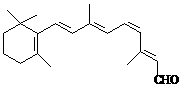
视黄醛(反式) 视黄醛(顺式)
(1)视黄醛的分子式为_____________,顺式视黄醛与反式视黄醛互为_______________。
(2)检验视黄醛分子中碳碳双键的方法是 。
(3)夜盲症是指人一到暗处或者到了晚上就看不清东西了的症状,主要原因是营养障碍,即维生素A1缺乏症。维生素A1进入体内在酶催化作用下被氧化生成反式视黄醛。实验测得维生素A1能发生加成反应和酯化反应。写出维生素A1氧化生成反式视黄醛的方程式________________
_____________________________________。引起夜盲症的还有可能的原因是_______________________________________。
(4)由植物来源的β-胡萝卜素称为维生素A 原,β-胡萝卜素的结构为:
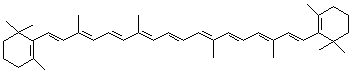
1 mol胡萝卜素最多能与 mol Br2反应。在体内β-胡萝卜素-15,15′-双氧酶(双加氧酶)催化下,可将β-胡萝卜素转变为两分子的视黄醛。这一变化过程属于_______________反应(填反应类型),这一反应还说明了酶作催化剂时的__________________________特点。
23.实验室可利用乙二醇、铜或铜的化合物制备乙二醛,下图是某兴趣小组设计的实验装置,右边的反应装置相同,而左边的气体发生装置不同,试管C中装有水(加热装置未画出)。试回答:

(1)两套装置中的A、B处都需加热,A处用 加热,B处用 加热。
(2)若按甲装置进行实验,B管处装铜粉,则通入A管的X是 。
(3)若按乙装置进行实验,则B管中应装 。
(4)实验结束后,取C试管中的溶液滴入新制备的银氨溶液中并采用水浴加热可观察到有银镜生成,写出该过程的化学方程式 。
(5)实验完成时先打开D处的铁夹,再撤去酒精灯,试说明这样做的目的是
。
22.在分子结构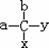 中,当a、b、x、y为彼此互不相同的原子或原子团时,称此分子为手性分子,中心碳原子为手性碳原子。某烃的含氧衍生物A,其蒸气对氢气的相对密度为57,含氧的质量分数为14. 04%。A具有手性,可以发生酯化反应和加成反应,A与氢气反应后的产物无手性。
中,当a、b、x、y为彼此互不相同的原子或原子团时,称此分子为手性分子,中心碳原子为手性碳原子。某烃的含氧衍生物A,其蒸气对氢气的相对密度为57,含氧的质量分数为14. 04%。A具有手性,可以发生酯化反应和加成反应,A与氢气反应后的产物无手性。
(1)A的分子式是_________________
(2)A分子中官能团的名称是________________________
(3)欲使A分子的手性消失,可通过发生_______________的方法。
a.加成反应 b.消去反应 c.酯化反应 d.氧化反应
(4)A在一定条件下发生分子内脱水得到B,B与溴以1:1加成时得到三种不同的产物,则B的结构简式是____________________,B在一定条件下发生聚合反应,反应的方程式是____________________________________
(5)C是A的同分异构体,C分子中含有一个六元环,C发生分子内脱水反应得到的产物只有一种,则C的结构可能是___________________________________
21.已知H2的燃烧热为285.8kJ·mol-1,反应过程中能量变化如下图:

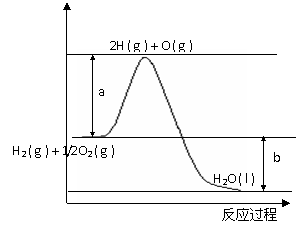

请回答下列问题:
(1)图中a,b分别代表什么意义?
a. ;b. 。
(2)该反应的△H (填“< 0”或“> 0”)。
(3)表示H2燃烧热的热化学方程式为____________________________________________,已知H2O(g)=H2O(l);△H=-44kJ·mol-1,标准状况下4.48LH2在1.00molO2中燃烧生成水蒸气时产生的热量为__________________kJ。
(4)已知下列化学键键能:H-H:436 kJ·mol-1,O=O:498 kJ·mol-1,则水分子中H-O键的平均键能为__________ kJ·mol-1
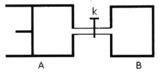
20.如图所示,向A和B中都充入2molX和2molY,起始VA=0.8aL,VB=aL,在相同温度和有催化剂的条件下,两容器中各自发生下列反应X(g)+Y(g) 2Z(g)+W(g),达到平衡时,VA=0.9 aL,则下列说法错误的是
2Z(g)+W(g),达到平衡时,VA=0.9 aL,则下列说法错误的是
A.两容器中达到平衡的时间A<B
B.A容器中X的转化率为25%,且比B容器中X的转化率小
C.打开K一段时间达平衡时,A的体积为0.8aL(连通管中气体体积不计);
D.打开K达新平衡后,升高B容器温度,A容器体积一定增大
第II卷 非选择题
19.某温度下,已知反应mX(g)+nY(g) qZ(g) △H>0,m + n>q,在体积一定的密闭容器中达到平衡,下列叙述不正确的是
qZ(g) △H>0,m + n>q,在体积一定的密闭容器中达到平衡,下列叙述不正确的是
A.反应速率v正(X)=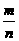 v逆(Y)
B.加入X,反应的△H增大
v逆(Y)
B.加入X,反应的△H增大
C.增加Y的物质的量,X的转化率增大 D.降低温度,c(Y)/c(Z)的值变小
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com