
题目列表(包括答案和解析)
5.下列溶液一定呈中性的是( )
A.pH=7的溶液 B.c(H+)=10-7mol·L-1的溶液
C.c(H+)/c(OH-)=10-14溶液 D.氨水和氯化铵的混合液中c(NH4+)=c(Cl-)
4.水的电离过程为H2O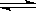 H++OH-,在不同温度下其平衡常数为K(25℃)=1.0×10-14,K(35℃)=2.1×10-14。则下列叙述正确的是( )
H++OH-,在不同温度下其平衡常数为K(25℃)=1.0×10-14,K(35℃)=2.1×10-14。则下列叙述正确的是( )
A.C(H+)随着温度升高而降低 B.在35℃时,C(H+)>C(OH-)
C.水的电离度?(25℃)>?(35℃) D.水的电离是吸热的
3.用蒸馏水稀释1 mol·L-1醋酸时,始终保持增大趋势的是 ( )
A.溶液中的c(CH3COO-) B.溶液中的c(H+).
C.溶液中的c(CH3COOH). D.溶液中的c(OH-)
2.常温下,在0.1 mol·L-1 CH3COOH溶液中,水的离子积是 ( )
A.1×10-14 B.1×10-13. C.1.32×10-14 D.1.32×10-15.
1.纯水在25℃和80℃时的氢离子浓度,前者和后者的关系是( )
A、前者大 B、相等 C、前者小 D、不能肯定
15.(10分)某化学兴趣小组,专门研究了氧族元素及其某些化合物的部分性质。查得资料如下:①常温下,硒(Se)和碲(Te)为固体,H2Se和H2Te为气体;
②Te和H2不能直接化合生成H2Te
③氧气、硫、硒、碲与1mol H2反应的焓变情况如下表所示。
|
物质 |
O2 |
S |
Se |
Te |
|
△H(kj·mol-1) |
-242 |
-20 |
81 |
 |
请回答下列问题:
(1)写出硒化氢发生反应的热化学方程式:
。
(2)已知298K时,H2Te分解反应的△S>0,△H=-154kj·mol-1,请解释Te和H2
不能直接化合的原因
。
(3)H2S的水溶液显弱酸性,写出其电离方程式 ;它的第一级电离常数可用Kal来表示,当温度升高时,Kal的值 (填“一定增大”、“一定减小”或“不能确定”)。
 16.(10分)向某一容积为1L的密闭容器中加入1molCO和1molH2O,在800℃条件下发生了反应CO (g) + H2O (g) CO 2
(g) + H2 (g),△H < 0
16.(10分)向某一容积为1L的密闭容器中加入1molCO和1molH2O,在800℃条件下发生了反应CO (g) + H2O (g) CO 2
(g) + H2 (g),△H < 0
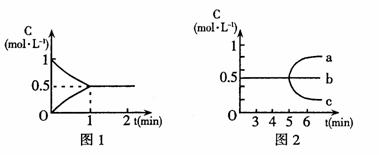 反应中各物质的浓度随时间而变化的情况如图
反应中各物质的浓度随时间而变化的情况如图
(1)该反应在800℃时的平衡常数为 。
(2)根据图1中数据知,反应开始至达到平衡时的平均反应速度v(CO)为 。
(3)反应达到平衡后,第5分钟时,(用图2中a~c编号回答)
①若降低温度,H2浓度变化正确的是
②若加入水蒸气,CO浓度变化正确的是
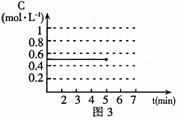 (4)反应达到平衡后,第5分钟时,将反应容器的容积压缩到原来的
(4)反应达到平衡后,第5分钟时,将反应容器的容积压缩到原来的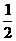 ,请在图3中画出5分钟后CO2浓度的变化情况。
,请在图3中画出5分钟后CO2浓度的变化情况。
14.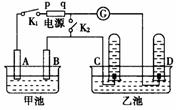 (18分)在右图均用石墨作电极的电解池中,甲池中为500mL含某一溶质的蓝色溶液,乙池中为500mL稀硫酸,闭合K1,断开K2进行电解,观察到A电极表面有红色的固态物质生成,B电极有无色气体生成;当溶液中的原有溶质完全电解后,停止电解,取出A电极,洗涤、干燥、称量,电极增重1.6g。
(18分)在右图均用石墨作电极的电解池中,甲池中为500mL含某一溶质的蓝色溶液,乙池中为500mL稀硫酸,闭合K1,断开K2进行电解,观察到A电极表面有红色的固态物质生成,B电极有无色气体生成;当溶液中的原有溶质完全电解后,停止电解,取出A电极,洗涤、干燥、称量,电极增重1.6g。
请回答下列问题:
(1)B电极发生反应的电极反应式 。
C电极发生反应的电极反应式 .
(2)甲池电解时反应的离子方程式 。
(3)甲池电解后溶液的pH为 ,要使电解后溶液恢复到电解前的状态,则需加入 ,其质量为 g。(假设电解前后溶液的体积不变)
(4)请你设计实验确定甲池原溶液中可能含有的酸根离子,要求:提出两种可能的假设,分别写出论证这两种假设的操作步骤、实验现象和实验结论
①假设一: ;
 ②假设二:
。
②假设二:
。
(5)若再将K1断开,闭合K2,灵敏电流计 中指针是否会发生偏转?理由是什么?
13.(14分)根据下列化合物回答问题:①NaC1、②NaON、③HC1、④NH4C1、⑤CH3COONa、⑥CH3COOH、⑦NH3·H2O、 ⑧H2O
(1)NH4C1溶液显 性,用离子方程式表示 ,其离子浓度大小顺序为 .
(2)pH=10的CH3COONa溶液中,水电离出来的c(OH-)为 ,在pH=3的CH3COOH溶液中水电离出来的c(H+)为 .
 (3)已知水存在如下平衡,H2O+H2O H3+O+OH-;△H>0,现欲使平衡向右移动,且所得溶液显酸性,选择方法是
.
(3)已知水存在如下平衡,H2O+H2O H3+O+OH-;△H>0,现欲使平衡向右移动,且所得溶液显酸性,选择方法是
.
A.向水中加入NaHSO4固体 B.向水中加Na2CO3固体
C.加热至100℃ D.向水中加入(NH4)2SO4固体
(4)若等浓度、等体积的②NaOH和⑦氨水分别加水稀释m倍、n倍,稀释后pH相等则m n.
12.将氨水缓缓地滴入盐酸中至中性,下列有关的说法:①盐酸过量 ②氨水过量 ③恰好完全反应 ④c (NH4+) = c(Cl-) ⑤c (NH4+) < c(Cl-) 正确的是 ( )
A.①⑤ B.③④ C.②⑤ D.②④
11. 已知HF比CH3COOH易电离。关于物质的量浓度、体积都相同的NaF溶液和CH3COONa溶液,下列说法正确的是 ( )
A.CH3COONa溶液中:c(CH3COO-)>c(Na+)>c(OH-)>c(H+)
B.在相同条件下,两溶液的pH大小为: CH3COONa< NaF
C.NaF溶液中:c(H+)+c(HF)= c(OH-)
D.两溶液相比较,CH3COONa溶液中的离子总数较多
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com