
题目列表(包括答案和解析)
3.室温时,0.01mol·L-1某一元弱酸的电离度为 1% ,则下列说法正确的是 ( )
A.上述弱酸溶液的 pH = 4
B.加入等体积 0.01mol·L-1NaOH 溶液后,所得溶液的 pH = 7
C.加入等体积 0.01mol·L-1NaOH 溶液后,所得溶液的 pH > 7
D .加入等体积 0.01mol·L-1NaOH 溶液后,所得溶液的 pH < 7
2.若pH = 3的酸溶液和pH = 11的碱溶液等体积混合后溶液呈酸性,其原因可能是( )
A.生成了一种强酸弱碱性盐 B.弱酸溶液和强碱溶液反应
C.弱酸溶液和弱碱溶液反应 D.一元强酸溶液和一元强碱溶液反应
1.用 0.1mol·L-1NaOH 溶液滴定 0.1mol·L-1盐酸,如达到滴定的终点时不慎多加了 1滴 NaOH 溶液(1滴溶液的体积约为 0.05mL),继续加水至 50mL,所得溶液的 pH 是 ( )
A.4 B.7.2 C.10 D.11.3
4、溶液稀释时pH的计算
①对于强酸溶液,c(H+)每稀释10n倍,pH增大n个单位,但不突破7。
②对于强碱溶液,c(OH-)每稀释10n倍,pH减小n个单位,但不突破7。
③对于pH相同的强酸与弱酸(或强碱与弱碱)稀释相同倍数时,pH变化程度不同,其结果是强酸(或强碱)pH变化大,而弱酸(或弱碱)pH变化小。
练习题
3、强酸强碱混合,其中一种物质过量的pH的计算
①酸过量时,先求c混(H+),再求pH,c混(H+)=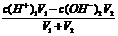
②碱过量,先算c混(OH-),再算c混(H+),最后算pH,c混(OH-)=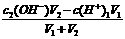
2、关于两强(强酸或强碱)混合pH的计算
①两强酸混合,先算c混(H+),再算pH,c混(H+)=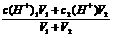
②两强碱混合,先算c混(OH-),再算c混(H+),最后算pH,c混(OH-)=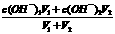
1、一种强酸或一种强碱的pH计算
强酸:先求c(H+),再求pH:如HnA,浓度为cmol/L,pH=-lgc(H+)=-lgnc。
强碱:先求c(OH-),然后由KW换算成c(H+),再求pH或直接求pOH,再根据关系式pH=14-pOH求。如B(OH)n,浓度为cmol/L,pH=-lgc(H+)=14+lgnc。
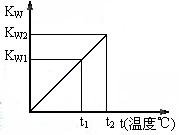
17.水的离子积常数KW与温度t(℃)的关系如右图所示:
(1)若t1=25℃,则KW1=_______;若t2=100℃时,KW2=
10-12,则0.05mol·L-1的Ba(OH)2溶液的pH=_______。
(2)已知25℃时,0.1L0.1mol·L-1的NaA溶液的pH=10,则
NaA溶液中所存在的化学平衡有(用离子方程式表示):
______________。溶液中各离子的物质的量浓度由大到小的顺序为________________。
(3)25℃时,将pH=11的NaOH溶液与pH=4的硫酸溶液混合,若所得混合溶液pH=9,则NaOH溶液与硫酸溶液的体积比为___________。
(4)100℃时,若10体积的某强酸溶液与1体积的某强碱溶液混合后溶液呈中性,则混合之前,该强碱的pH(pH酸)与强碱的pH(pH碱)之间应满足的关系为:
pH(酸)+pH(碱)=_______________。
溶液的酸碱性、pH 值及计算
重点回顾:
⒈定义:PH= ,广泛pH的范围为0-14。
注意:当溶液中[H+]或[OH-]大于1mol/L时,不用pH表示溶液的酸碱性。
⒉溶液的酸碱性:
溶液的酸碱性 常温(25℃)
中性溶液:C(H+) C(OH-) C(H+) 1×10- 7mol/L pH 7
酸性溶液:C(H+) C(OH-) C(H+) 1×10-7mol/L pH 7
碱性溶液:C(H+) C(OH-) C(H+) 1×10-7mol/L pH 7
⒊溶液PH的测定方法
(1)酸碱指示剂法
说明:常用的酸碱指示剂有石蕊、甲基橙、酚酞试液。
常用酸碱指示剂的pH变色范围
|
指示剂 |
变色范围的pH |
||
|
石蕊 |
<5 色 |
5-8 色 |
>8 色 |
|
甲基橙 |
<3.1 色 |
3.1-4.4 色 |
>4.4 色 |
|
酚酞 |
<8 色 |
8-10 色 |
>10 色 |
(2)pH试纸法
使用方法:
(3)PH计法
1.456L(标准状况下),此时溶液体积仍然为100 mL 。计算
(1)加入金属钠的质量
(2)反应后溶液的pH
16.把一小块金属钠投入100 mL 0.15 mol/LCuCl2溶液中,收集到产生的气体的体积为
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com