
题目列表(包括答案和解析)
1.甲酸的下列性质中可以证明它是弱电解质的是
A.1 mol·L-1的甲酸溶液的c(H+)约为0.01 mol·L-1
B.甲酸与水以任意比例互溶
C.10 mL 1 mol·L-1甲酸恰好与10 mL 1 mol·L-1NaOH溶液完全反应
D.同温同压时,甲酸的导电性比一元强酸溶液的弱
3.以醋酸为例判断条件改变时,电离平衡的影响
|
|
平衡移动方向 |
c(H+) |
c(CH3COO-) |
c(CH3COOH) |
Ka |
|
升高温度 |
|
|
|
|
|
|
加水稀释 |
|
|
|
|
|
|
加纯醋酸 |
|
|
|
|
|
|
加NaOH |
|
|
|
|
|
|
加HCl |
|
|
|
|
|
|
加CH3COONa |
|
|
|
|
|
练习题
2、影响电离平衡的外界因素
(1)温度:温度升高,电离平衡 移动,电离程度 。
温度降低,电离平衡 移动,电离程度 。
(2)浓度:电解质溶液浓度越大,平衡 移动,电离程度 ;
电解质溶液浓度越小,平衡 移动,电离程度 ;
1、电离平衡常数:一元弱酸电离平衡常数:
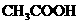


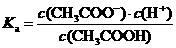
(1)电离平衡常数只随温度变化而变化,而与溶液浓度无关。
(2)K的意义:
K值越大,弱电解质较易电离,其对应弱酸、弱碱较 。
K值越小,弱电解质较难电离,其对应弱酸、弱碱较 。
19.(1)体积相同,浓度均为0.2 mol/L的盐酸和CH3COOH溶液,分别加水稀释10倍,溶液的pH分别变成m和n,则m与n的关系为______________。
(2)体积相同,浓度均为0.2mol/L的盐酸和CH3COOH溶液,分别加水稀释m倍、n倍,溶液的pH都变成3,则m与n的关系为______________。
(3)体积相同,pH均等于1的盐酸和CH3COOH溶液,分别加水稀释m倍、n倍,溶液的pH都变成3,则m与n的关系为______________。
(4)体积相同,pH均等于13的氨水和NaOH溶液,分别加水稀释m倍、n倍,溶液的pH都变成9,则m与n的关系为______________。
弱电解质的电离
重点回顾:
18、下表是某温度下测得某酸溶液的一些数据,由表中的数据填空:
|
溶液的物质的量浓度/mol·L-1 |
电离度/% |
H+的物质的量浓度/mol·L-1 |
pH |
|
0.1 |
2α |
c1 |
x |
|
c |
α |
2c1 |
3 |
则 c= ;α = ;c1= ;x=
17.某温度(t℃)时,测得0.01mol·L-1的NaOH溶液的pH为11,则该温度下水的KW= 。在此温度下,将 pH = a的 NaOH 溶液 VaL 与 pH = b的 H2SO4溶液 VbL 混合,
(1)若所得混合液为中性,且 a= 12,b= 2,则 Va∶Vb= ;
(2)若所得混合液为中性,且 a+ b= 12,则 Va∶Vb= ;
(3)若所得混合液的 pH = 10,且 a= 12,b= 2,则 Va∶Vb= 。
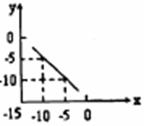
16、某温度下的溶液中,c(H+)= 10xmol/L,c(OH-)= 10ymol/L。x与 y的关系如右图所示:
(1)求该温度下,中性溶液的 pH。
(2)求该温度下 0.01mo/LNaOH 溶液的 pH。
(3)该温度下,pH = a的醋酸溶液与 pH = b 的 NaOH 溶液等体积混合,恰好完全反应,求此醋酸溶液中醋酸的电离度。
选做题
15.已知浓度均为0.1mol/L的8种溶液:①HNO3 ②H2SO4 ③HCOOH ④Ba(OH)2 ⑤NaOH ⑥CH3COONa ⑦KCl ⑧NH4Cl其溶液pH由小到大的顺序是______________________。
14.25℃时向纯水中加入NaOH使其浓度为0.1 mol / L,则此时溶液中水电离出的c(OH-)是 mol / L。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com