
题目列表(包括答案和解析)
2.在常温下10 mL pH=10的KOH溶液中,加入pH=4的一元酸HA溶液至pH刚好等于7(假设反应前后体积不变),则对反应后溶液的叙述正确的是
A.c(A-)=c(K+) B.c(H+)=c(OH-)<c(K+)<c(A-)
C.V后≥20 mL D.V后≤20 mL
1.常温下,将甲酸和氢氧化钠溶液混合,所得溶液pH=7,则此溶液中
A.c(HCOO-)>c(Na+) B.c(HCOO-)<c(Na+)
C.c(HCOO-)=c(Na+) D.无法确定c(HCOO-)与c(Na+)的关系
(五)盐类水解原理的应用
1.制备胶体或解释某些盐有净水作用
FeCl3、Kal2(SO4)2·12H2O等可作净水剂.
原因: .
2.某些盐溶液的配制、保存
在配制FeCl3、AlCl3、SnCl2等溶液时为防止水解,应加入少量 .Na2SiO3、Na2CO3等不能贮存磨口玻璃塞的试剂瓶中,因
3.泡沫灭火器内反应原理.
NaHCO3和Al2(SO4)3混合可发生双水解反应:
4.热的纯碱液去油污效果好.原因:
5.铵态氮肥不能与草木灰混合使用:
盐类水解练习题
(四)比较外因盐水解的影响.
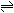 A-+H2O
HA+OH-
A-+H2O
HA+OH-
温度(T)T↑ 平衡 移, 水解程度
加水 平衡 移, 水解程度 。 增大[H+] 平衡 移, 水解程度
增大[OH-] 平衡 移, 水解程度 。 增大[A-] 平衡 移, 水解程度
思考:①弱酸的电离和弱酸根离子的水解互为可逆吗?
②在CH3COOH和CH3COONO2的溶液中分别加入少量冰醋酸,对CH3COOH电离程度 和CH3COO-水解程度各有何影响?
(三)影响水解的因素 内因:盐的本性.
外因:浓度、温度、溶液碱性的变化
(1)温度不变,浓度越小,水解程度 .
(2)浓度不变,温度越高,水解程度 .
(3)改变溶液的pH值,可抑制或促进水解。
(二)水解规律 简述为:
1.正盐溶液 ①强酸弱碱盐呈 。②强碱弱酸盐呈 。
③强酸强碱盐呈 。④弱酸弱碱盐不一定
2.酸式盐
①若只有电离而无水解,则呈酸性(如NaHSO4)
②若既有电离又有水解,取决于两者相对大小 电离程度>水解程度,呈
电离程度<水解程度,呈
③常见酸式盐溶液的酸碱性 碱性:NaHCO3、NaHS、Na2HPO4、NaHS.
酸性:NaHSO3、NaH2PO4、NaHSO4
(一) 盐的水解实质: 。
1.甲酸和乙酸都是弱酸,当它们的浓度均为0.10mol/L时,甲酸中的c(H+)约为乙酸中c(H+)的3倍。现有两种浓度不等的甲酸溶液a和b,以及0.10mol/L的乙酸,经测定它们的pH从大到小依次为a、乙酸、b。由此可知
A.a的浓度必小于乙酸的浓度 B.a的浓度必大于乙酸的浓度
C.b的浓度必小于乙酸的浓度 D.b的浓度必大于乙酸的浓度
2.用水稀释0.1 mol·L-1氨水时,溶液中随着水量的增加而减小的是
A.c(OH-)/c(NH3·H2O) B.c(NH3·H2O)/c(OH-)
C.c(H+)和c(OH-)的乘积 D.OH-的物质的量
3. 某二元弱酸(H2A)溶液,按下式发生一级和二级电离:
H2A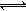 H++HA- HA-
H++HA- HA-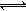 H++A2-
H++A2-
已知相同浓度时的电离度α(H2A)>>α(HA-),设有下列四种溶液:
A.0.01mol·L-1的H2A 溶液
B.0.01mol·L-1的NaHA 溶液
C.0.02mol·L-1的HCl溶液与0.04mol·L-1的NaHA溶液等体积混合液
D.0.02mol·L-1的NaOH溶液与0.02mol·L-1的NaHA溶液等体积混合液
据此,填写下列空白(填代号):
(1)c(H+)最大的是 ,最小的是
(2)c(H2A)最大的是 ,最小的是
(3)c(A2-)最大的是 ,最小的是
盐类的水解
重点回顾
15.对比同体积、同浓度的盐酸和醋酸,c(H+)前者 后者,与碱完全中和时,消耗NaOH的物质的量是前者 后者,与足量的Zn反应产生H2的速率是前者 后者,产生H2的量是前者 后者。(填“>”、“<”或“=”)
14.在稀氨水中存在平衡:NH3+H2O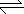 NH
NH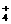 +OH-,如进行下列操作,则NH3、NH
+OH-,如进行下列操作,则NH3、NH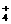 、H+、OH-浓度如何变化?试用“增大”“减小”“不变”填写。 (1)通适量HCl气体时,c(NH3)
,c(H+)
。
、H+、OH-浓度如何变化?试用“增大”“减小”“不变”填写。 (1)通适量HCl气体时,c(NH3)
,c(H+)
。
(2)加入少量NaOH固体时,c(NH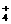 )
,c(OH-)
。
)
,c(OH-)
。
(3)加入NH4Cl晶体时,c(NH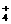 )
,c(OH-)
。
)
,c(OH-)
。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com