
题目列表(包括答案和解析)
9.能正确表示下列反应的离子方程式是
A.饱和碳酸氢钙溶液中加入饱和氢氧化钙溶液 Ca2+ + HCO3- + OH- = CaCO3↓+ H2O
B.氯化亚铁溶液中加入硝酸 Fe2+ + 4H+ + NO3- = Fe3+ + 2H2O + NO↑
C.氯气通入冷的氢氧化钠溶液中 2Cl2 + 2OH- = 3Cl- + ClO-+ H2O
D.氨水中通入过量CO2 2NH3·H2O + CO2 = 2NH4+ + CO32- + H2O
8.(广东省南宫中学2009届高三9月份月考 )下列叙述中正确的是
A.液态HBr不导电,因此HBr是非电解质
B.强电解质溶液的导电性不一定很强
C.NH3的水溶液能导电,因此NH3是电解质
D.强电解质在液化时一定能导电
7.下列离子方程式书写正确的是
A.过量的SO2 通人NaOH溶液中:SO2 + 2OH- = SO32- + H2O
B.Fe(NO3)3溶液中加入过量的HI溶液:2Fe3+ +2I- =2Fe2+ + I2
C.NaNO2溶液中加入酸性KMnO4溶液:2MnO4- +5NO2-+6H+ =2Mn2+ +5NO3-+3H2O D.NaHCO3溶液中加入过量的Ba(OH)2溶液:2HCO3- + Ba2++2OH-=BaCO3↓+2H2O+CO32-
6.己知碳酸钙和氢氧化钙在水中存在下列溶解平衡Ca(OH)2(s)
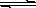 Ca2+ + 2OH-,
Ca2+ + 2OH-,
CaCO3(s) 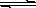 Ca2+ + CO32-。在火力发电厂燃烧煤的废气中往往含有SO2、O2、N2,CO2等,为了除去有害气体SO2变废为宝,常常见粉末状的碳酸钙或熟石灰的悬浊液洗涤废气,反应产物为石膏。
Ca2+ + CO32-。在火力发电厂燃烧煤的废气中往往含有SO2、O2、N2,CO2等,为了除去有害气体SO2变废为宝,常常见粉末状的碳酸钙或熟石灰的悬浊液洗涤废气,反应产物为石膏。
(1)写山上述两个反应的化学方程式:
①S02与CaCO3悬浊液反应
②S02与Ca(OH)2悬浊液反应
(2)试说明用熟石灰的悬浊液而不用澄清石灰水的理由
5.在2mL物质的量浓度相等的NaCl和NaI混合溶液中滴入几滴AgNO3溶液,发生的反应为
A.只有AgCl沉淀生成 B.只有AgI沉淀生成
C.生成等物质的量的AgCl和AgI沉淀 D.两种沉淀都有,但以AgI为主
4.铝和镓的性质相似,如M(OH)3都是难溶的两性氢氧化物。在自然界镓常以极少量分散于铝矿,如Al2O3中。用NaOH溶液处理铝矿(Al2O3)时,生成NaAlO2、NaGaO2;而后通入适量CO2,得Al(OH)3沉淀,而NaGaO2留在溶液中(循环多次后成为提取镓的原料)。发生后一步反应是因为
A、镓酸酸性强于铝酸 B、铝酸酸性强于镓酸
C、镓浓度小,所以不沉淀 D、Al(OH)3是难溶物
3.下列有关离子反应的叙述不正确的是
A.溶液中有难溶于水的沉淀生成是离子反应的发生条件之一
B.离子反应发生的方向总是向着溶液中离子浓度降低的方向进行
C.离子反应生成的沉淀的溶解度为零
D.生成沉淀的离子反应之所以能发生,在于生成物的溶解度小
2.对于难溶盐MX,其饱和溶液中M+和X-的物质的量浓度之间的关系类似于C(H+)C(OH-)=Kw,存在等式C(M+)C(X-)=Ksp。现将足量AgCl分别放入下列物质中,AgCl的溶解度由大到小的排列顺序是
①20ml0.01mol/LKCl溶液②30ml0.02mol/LCaCl2溶液③40ml0.03mol/LHCl溶液④10ml蒸馏水⑤50ml0.05mol/LAgNO3溶液
A. ①>②>③>④>⑤B. ④>①>③>②>⑤C. ⑤> ④>②>①>③D. ④>③>⑤>②>①
1. 已知250C时,Ka(HF)=3.6*10-4Ksp(CaF2)=1.46*10-10。现向1L0.2mol/LHF溶液中加入1L0.2mol/LCaCl2溶液,则下列说法中,正确的是:( )
A.250C时,0.1mol/LHF溶液的PH=1
B.Ksp(CaF2)随浓度和温度的变化而变化。
C.该体系中没有沉淀产生。
D.该体系中HF与CaCl2反应产生沉淀。
3、离子方程式书写步骤(以H2SO4与Ba(OH)2反应为例说明): ①写:写出并配平反应的化学方程式:
②拆:把易溶于水的强电解质拆成离子形式,其他仍以分子形式书写: 。
③删:删去两边未反的离子:此反应中没有不参加反应的离子
④查:检查两边的元素是否守恒、电荷数是否守恒、电子得失是否守恒、该用=号还是 号、有没有漏写↑、↓等符号。
7、离子反应发生的条件
(1)复分解反应型:这类反应发生的条件是:(1)
;(2)
(弱
酸、弱碱、水);(3)
(如CO2、HCl等)
(2)离子反应若属氧化还原反应,其反应发生条件应遵照氧化还原反应规律进行。
8、离子能否大量共存的判断
(1)在强酸性条件下(即有大量H+),不能大量共存的离子有:
。
(2)在强碱性条件下(即有大量OH-);不能共存的离子有:
。 (3)相互反应生成沉淀的离子间不能大量共存,如
。 (4)相互反应生成气体的离子间不能大量共存,如
。 (5)相互反应生成难电离的物质(及弱电解质)的离子间不能大量共存,如
。
号、有没有漏写↑、↓等符号。
7、离子反应发生的条件
(1)复分解反应型:这类反应发生的条件是:(1)
;(2)
(弱
酸、弱碱、水);(3)
(如CO2、HCl等)
(2)离子反应若属氧化还原反应,其反应发生条件应遵照氧化还原反应规律进行。
8、离子能否大量共存的判断
(1)在强酸性条件下(即有大量H+),不能大量共存的离子有:
。
(2)在强碱性条件下(即有大量OH-);不能共存的离子有:
。 (3)相互反应生成沉淀的离子间不能大量共存,如
。 (4)相互反应生成气体的离子间不能大量共存,如
。 (5)相互反应生成难电离的物质(及弱电解质)的离子间不能大量共存,如
。
练习题
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com