
题目列表(包括答案和解析)
2、在一定温度下,在定压容器a与定容容器b中,分别盛入体积比为1:3的N2和H2,开始时体积相同,达到平衡时,N2的转化率应该是( )
a大 B.b大 C.a、b一样大 D.不一定
1、某条件下合成氨达平衡时氨的体积分数为25%,若反应前后条件保持不变,则反应后缩小的气体体积与原反应物体积的比是( )
A.1/5 B.1/4 C.1/3 D1/2
4.合成氨的适宜条件 根据反应器的钢材质量即综合指标选择压强
氮气与氢气的物质的量比为 的投料比
二:基础训练
3.合成氨速率分析
 ①
①
②
有利于提高化学反应速率 ③
④
选择合成氨条件时,不能片面地追求高转化率或高反应速率,而应该寻找以较高的反应速率获得适当的平衡转化率的条件。此外还要考虑原料的价格、未转化合成气的循环使用,反应热的综合利用等问题。
 作催化剂
作催化剂
温度在 K左右
2.合成氨反应限度分析
 ①
①
有利于提高转化率的条件 ②
③
1.298K时,N2(g)+3H2(g)  2NH3 (g) ⊿H=-92.2KJ·mol-1 ⊿S=-198
J·K-1·mol-1
2NH3 (g) ⊿H=-92.2KJ·mol-1 ⊿S=-198
J·K-1·mol-1
(1)温度:从反应速率分析,温度 越好;从反应平衡分析,温度 越好。综合考虑以 K左右为宜,而且在此温度下 的活性最高。
(2)压强:无论从速率还是平衡考虑,压强 越利于合成氨。但压强越大,对设备的制造和材料的强度要求越高,应根据设备选择 的高压。
(3).催化剂: 反应速率但不影响平衡,提高单位时间氨的产量,目前工业上以
为催化剂
(4)浓度:从速率及平衡角度分析,应提高 , 浓度,降低 浓度。
20、一种澄清透明的溶液中可能含有下列离子:
K+、Fe3+、Ba2+、Al3+、NH4+、Cl-、I-、NO3-、HCO3-、SO32-、SO42-现做以下实验:
⑴将溶液滴在蓝色石蕊试纸上,试纸呈红色
⑵取少量溶液,加入用稀硝酸酸化的BaCl2溶液,产生白色沉淀
⑶将⑵中的沉淀过滤。由滤液中加入硝酸银溶液,产生白色沉淀
⑷另取溶液,逐滴加入氢氧化钠溶液至过量,只观察到有红棕色沉淀生成,且沉淀量不减少。由此可以推断:
溶液中肯定存在的离子有: 。
溶液中肯定不存在的离子有: 。
溶液中还不能确定是否存在的离子有: 。
19、准确移取25.00mL某未知浓度的盐酸溶液于一洁净锥形瓶中,然后用0.20mol/L NaOH溶液滴定(指示剂为酚酞)。滴定结果如下:
|
|
NaOH溶液起始读数 |
NaOH溶液终点读数 |
|
第一次 |
0.01mL |
18.60mL |
|
第二次 |
0.20mL |
18.00mL |
(1)根据以上数据可计算出盐酸的物质的量浓度为 mol/L。(精确到0.01)
(2)如标准NaOH溶液由于保存不妥而变质(和空气中CO2反应产生少量Na2CO3测出的盐酸浓度 (填“偏高”、“偏低”或不变”)。
(3)若操作有误,则导致待测盐酸溶液浓度偏低的错误操作是 (填序号)。
A.滴定管用蒸馏水洗后未用标准碱液润洗,直接装入标准碱液
B.滴定前滴定管尖端有气泡,滴后气泡消失
C.滴定管读数时,滴定前仰视滴定后俯视
D.待测液中指示剂酚酞(为有机弱酸)加得太多
(4)如果准确移取25.00mL 0.20mol/L NaOH溶液于锥形瓶中,滴入酚酞指示剂,然后用未知浓度的盐酸(装在酸式滴定管中)滴定,是否也可测定出盐酸的物质的量浓度? 填 “是”或“否”)
18、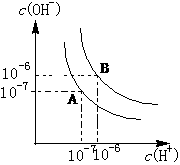 水的电离平衡如右图所示.
水的电离平衡如右图所示.
(1)若A点表示25℃时水的电离平衡状态,当升高温度至100℃时水的电离平衡状态为B点,则此时水的离子积为 .
(2)将100℃时pH=8的Ba(OH)2溶液与pH=5的盐酸混合,并保持100℃的恒温,欲使混合溶液的pH=7,则Ba(OH)2溶液与盐酸的体积比为 .
(3)已知AnBm的离子积=c(Am+)n•c(Bn-)m,若某温度下Ca(OH)2的溶解度为0.74g,其饱和溶液的密度为1g/mL,其离子积为 .
17、向含有Cl-、Br-、I-、Fe2+的溶液中,逐滴加入新制的溴水至足量,反应后溶液中离子数量明显减少的是 ;离子数量明显增多的是 ;离子数量基本不变的是 ;发生反应的离子方程式依次为 。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com