
题目列表(包括答案和解析)
22、(9分)(1)金属腐蚀一般可分为化学腐蚀和__________腐蚀。
(2)炒过菜的铁锅未及时洗净容易发生腐蚀。
①若铁锅内残液呈弱酸性,则腐蚀主要属于 _________(填“吸氧”或“析氢”,下同)腐蚀;若残液中主要含有NaCl,腐蚀应主要属于____________腐蚀。
②吸氧腐蚀中,负极的电极反应式为__________________。
铁锈中铁的化合价为 _____。
(3)如果在铁的表面镀上一层铜,就可以防止铁生锈,则在电镀过程中铁为 极,电极反应式为 ,铜为 极,电极反应式为 。
21、(12分)(1)今有2H2+O2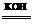 2H2O反应,构成燃料电池,则负极通的应是________,正极通的应是_______,电极反应式为:_______、_____。
2H2O反应,构成燃料电池,则负极通的应是________,正极通的应是_______,电极反应式为:_______、_____。
(2)如把KOH改为稀H2SO4作导电物质,则电极反应式为 _____、 ____。
(3)如把H2改为甲烷,KOH做导电物质,则电极反应式为__ _、_ __。
20、下列说法中正确的是
(A)物质的溶解性为难溶,则该物质不溶于水
(B)不溶于水的物质溶解度为0
(C)绝对不溶的物质是不存在的
(D)某离子被沉淀完全是指该离子在溶液中的浓度为0
(II)卷
19、为了保护地下钢管不受腐蚀,可使它与
(A)直流电源正极相连 (B)铜板相连
(C)铅板相连 (D)直流电源负极相连
18、叠氮酸(HN3)与醋酸酸性相似,下列叙述中错误的是
(A)水溶液中微粒浓度大小顺序为:c(HN3)>c(H+)>c(N3-)>c(OH-)
(B)HN3与NH3作用生成的叠氮酸铵是共价化合物
(C)NaN3水溶液中离子浓度大小顺序为: c(Na+)>c(N3-) >c(OH-)>c(H+)
(D)N3-与CO2含相等电子数
17、从下列实验事实所引出的相应结论正确的是
|
选项 |
实
验 事 实 |
结 论 |
|
A |
其他条件相同,硫代硫酸钠溶液浓度越大,析出硫沉淀所需时间越短 |
当其他条件不变时,增大反应物浓度化学反应速率加快 |
|
B |
在化学反应前后,催化剂的质量和化学性质都没有发生改变 |
催化剂一定不参与化学反应 |
|
C |
H+浓度相同的盐酸和醋酸分别与少量等质量的形状相同的锌粒反应 |
反应所需时间相同 |
|
D |
在容积可变的密闭容器中发生反应:H2(g)+I2(g)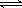 2HI(g),把容积缩小一倍 2HI(g),把容积缩小一倍 |
正反应速率加快,逆反应速率不变 |
16、常温下,将PH=6的某酸溶液与PH=8的氢氧化钡溶液等体积混和,所得溶液的PH值是
(A)=7 (B)≥7 (C)≤7 (D)>7
15、关于小苏打水溶液的表述正确的是
(A)c(Na+) = 2c(HCO3-) + 2c(CO32-) + 2c(H2CO3)
(B)c(Na+)+ c(H+) = c(HCO3-) + c(OH-) + c(CO32-)
(C)HCO3-的电离程度大于HCO3-水解程度
(D)存在的电离有NaHCO3
= Na+ + HCO3-, HCO3-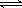 CO32- + H+,H2O
CO32- + H+,H2O
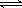 H+
+ OH-
H+
+ OH-
14、银锌电池广泛用作各种电子仪器的电源,它的充电和放电过程可表示为
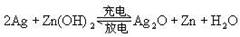 ,在此电池放电时,负极上发生反应的物质是
,在此电池放电时,负极上发生反应的物质是
(A)Ag ( B)Zn(OH)2 (C)Ag2O (D)Zn
13、把一小块镁、铝合金放入 6mol/L的氢氧化钠溶液中 ,可以形成微型原电池 ,则该电池负极的电极反应为
(A)Mg-2e-=Mg2+ (B) 2Al+8OH--6e-=2AlO2-+4H2O
(C)4OH--4e-=2H2O+O2 ↑ (D)2H2O+2e-=2OH-+H2↑
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com