
题目列表(包括答案和解析)
24. (8分)已知:(A)Cu2+,Fe2+在pH为4-5的条件下不水解而Fe3+却几乎全部水解;(B)双氧水(H2O2)是强氧化剂,在酸性条件下,它的还原产物是H2O。用粗氧化铜(CuO中含少量Fe)制取CuCl2溶液过程如下:
①取50mL纯净的盐酸,加入一定量的粗CuO加热搅拌,充分反应后过滤,经测定溶液的pH是3
②向滤液中加入双氧水,搅拌。
③向②中加入过量纯CuO,微热,搅拌,此时测定溶液的pH为4,过滤。
④把③所得滤液浓缩。
填空:
(1)②中发生反应的离子方程式是________________________。
(2)③中过滤后滤渣的成分是________________________。
(3)①③中如何用pH试纸测定溶液的pH值:_____________________________。
(4)③中pH升高的原因是:________________________。(用离子方程式表示)
23.(14分)实验室现有下列药品:①蒸馏水;②用HNO3酸化的AgNO3溶液;③熟石灰;④Na2CO3;⑤NaCl;⑥食醋;⑦废干电池(锌筒内填有炭粉、MnO2、NH4Cl、淀粉等糊状物)。某课外兴趣小组同学准备进行下列实验研究:
(1)利用上述药品制NaOH溶液的化学方程式是______________________。
(2)为制备NH3,可先从废干电池中制备NH4Cl。假设将废电池中的混合物溶于少量的水中,过滤 除去不溶物,再蒸发滤液,以制得干燥的NH4Cl晶体。你认为这一设想是否合理?答:____________________________,其理由是________________________ 。
(3)他们在进行除去淀粉溶液中食盐的实验时,用鸡蛋壳膜自制了一个半透膜小袋,向其中装入混有NaCl的淀粉溶液,扎好袋口,这一实验的操作名称为___________。要保证全部除去淀粉溶液里的食盐,实验中必须_________________________________。
(4)由于实验(2)中NH4Cl的制备较困难,且难以满足量的要求,现重新提供足量的浓氨水、浓NaOH溶液和NH4Cl晶体,请设计一个最简单的实验,以快速制得NH3。
①你设计的实验方案是_________________________________________________。
②请运用化学原理对你的方案予以解释___________________________________。
22.(8分)用石墨做电极电解:① 稀H2SO4 ②K2SO4溶液 ③CuCl2溶液 ④CuSO4 溶液 ⑤KOH溶液。
(1)阴阳极都有气体产生,且体积比(相同条件下)为2∶1的是______(填序号,下同),其阳极的电极反应式都是_________________,阴极的电极反应式都是_________________,总反应的化学方程式是______________________。
(2)阴极.阳极都有气体产生,其中溶液的pH变小的是___________, pH变大的是___________。
(3)一个电极析出金属,一个电极析出气体,且溶液pH明显减小的是________,其总反应的化学方程式是______________________.
21.(6分)已知某溶液中只存在OH-、H+、Na+、CH3COO-四种离子,某同学推测其离子浓度大小顺序有如下四种关系:
①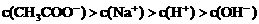
②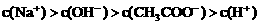
③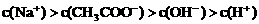
④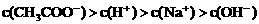
填写下列空白:
(1)若溶液中溶解了一种溶质,则该溶质是______________,则该溶液中四种离子浓度的大小顺序符合上述4种关系中的______________。(填序号)
(2)若上述关系①是正确的,则溶液中的溶质为______________;若上述关系②是正确的,则溶液中的溶质为______________。
(3)若该溶液是由体积相等的NaOH溶液和醋酸混合而成,且恰好呈中性,则混合前c(NaOH) ______________c(CH3COOH)(填“大于”、“小于”、或“等于”,下同),混合后溶液中C(CH3COO-)______________C(Na+)。
20.(8分)在一定体积的密闭容器中,进行如下化学反应:
CO2(g)+H2(g) CO(g)+H2O(g),其化学平衡常数K和温度t的关系如下表:
CO(g)+H2O(g),其化学平衡常数K和温度t的关系如下表:
|
t℃ |
700 |
800 |
830 |
1000 |
1200 |
|
K |
0.6 |
0.9 |
1.0 |
1.7 |
2.6 |
回答下列问题:
(1)该反应的化学平衡常数表达式为K=____________________________________;
(2)该反应为______反应(选填吸热、放热);
(3)某温度下,平衡浓度符合下式:3c(CO2)·c(H2)=5c(CO)·c(H2O),试判断此时的温度为______℃;
(4)830℃时,向该容器中加入1L CO2与1L H2 ,平衡时CO2的体积分数是______。
19.可用于电动汽车的铝-空气燃料电池,通常以NaCl溶液或NaOH溶液为电解液,铝合金为负极,通空气电极为正极。下列说法正确的是
A.以NaCl溶液或NaOH溶液为电解液时,正极反应都为:O2+2H2O+4e-=4OH-
B.以NaOH溶液为电解液时,负极反应为:Al+3OH--3e-=Al(OH)3↓
C.以NaOH溶液为电解液时,电池在工作过程中电解液的pH保持不变
D.电池工作时,电子通过外电路从正极流向负极
第Ⅱ卷 (非选择题,共52分)
18.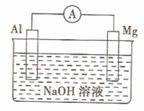 将Mg条、Al条平行插入一定浓度的NaOH溶液中,用电器连接成原电池。此电池工作时,下列叙述中正确的是
将Mg条、Al条平行插入一定浓度的NaOH溶液中,用电器连接成原电池。此电池工作时,下列叙述中正确的是
A. Mg比Al活泼,Mg失去电子被氧化成Mg2+
B. Al条表面虽有氧化膜,但可不必处理
C. 该电池的内、外电路中,电流均是由电子定向移动形成的
D. Al是电池负极,开始工作时溶液中会立即有白色沉淀析出
17.在容积不变的密闭容器中,在一定条件下发生反应2A(?) B(g)+C(s),达到化学平衡后,其他条件不变,升高温度时,容器内气体的密度增大,则下列叙述正确的是
B(g)+C(s),达到化学平衡后,其他条件不变,升高温度时,容器内气体的密度增大,则下列叙述正确的是
A. 如反应是吸热反应,则为A气态
B. 如反应是放热反应,则为A气态
C. 在平衡体系中加入少量C,则平衡逆向移动
D. 改变压强对平衡的移动无影响
16.下列方法中不能使10mL硫酸的pH由1变为2的是(两种液体混合后体积的变化忽略不计)
A.加90mL 水稀释
B.加100mL pH=3的H2SO4溶液
C.加10mL 0.01 mol/L NaCl 溶液
D.加45mL 0.01 mol/L NaOH溶液
15.以铁为阳极、铜为阴极,对足量的NaOH溶液进行电解,一段时间后得到2molFe(OH)3沉淀,此时消耗水的物质的量共为
A. 2mol B. 3mol
C. 4mol D. 5mol
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com