
题目列表(包括答案和解析)
81.原电池产生电流的本质原因是( )
A.原电池中溶液能电离出自由移动的离子
B.有两根导线将两个活泼性不同的电极连接
C.电极上进行的氧化还原反应的生成物为电子
D.电极上进行的氧化还原反应中会有电子的转移
80.某金属能跟稀盐酸作用放出氢气,该金属与锌组成原电池时,锌为负极,此金属是( )
A.镁 B.铁 C.铝 D.铜
79.某溶液中只含有Na+、H+、OH-、A-四种离子,下列说法正确的是( )
A. 若溶液中c(A-)=c(Na+),则溶液一定呈中性
B. 溶液中不可能存在:c(Na+)> c(A-)> c(OH-)> c(H+)
C. 若c(OH-)> c(H+),溶液中不可能存在:c(Na+)> c(OH-)> c(A-)> c(H+)
D. 若溶质为NaA、HA,则一定存在:c(A-)> c(Na+)> c(H+)> c(OH-)
78、已知CuSO4溶液分别与Na2CO3溶液、Na2S溶液的反应情况如下:
(1) CuSO4 +Na2CO3 主要反应:Cu2+ + CO32- + H2O = Cu(OH)2↓+ CO2↑
次要反应:Cu2+ + CO32- = CuCO3↓
(2) CuSO4 +Na2S 主要反应:Cu2+ + S2─ = CuS↓
次要反应:Cu2+ + S2─+ 2H2O = Cu(OH)2↓+ H2S↑
则下列几种物质的溶解度大小的比较中,正确的是 ( )
A. Cu(OH)2<CuCO3<CuS B. CuS >Cu(OH)2>CuCO3
C. Cu(OH)2>CuCO3>CuS D. CuS <Cu(OH)2<CuCO3
77、在相同温度时,100mL0.01mol•L-1的醋酸溶液与10mL 0.1mol•L-1的醋酸溶液相比较,下列数值中,前者大于后者的是( )
A. H+的物质的量 B. 醋酸的电离常数
C. 中和时所需NaOH的量 D. CH3COOH的物质的
76、常温下pH=4的FeCl3溶液和pH=10的K2CO3溶液中,水的电离程度( )
A. FeCl3溶液大 B. K2CO3溶液大 C. 一样大 D. 无法确定
75、.将纯水加热至较高温度,下列叙述正确的是 ( )
A. 水的离子积变大、pH变小、呈酸性
B. 水的离子积不变、pH不变、呈中性
C. 水的离子积变小、pH变大、呈碱性
D. 水的离子积变大、pH变小、呈中性
74、下列有关“电离平衡”的叙述正确的是( )
A. 电解质在溶液里达到电离平衡时,分子的浓度和离子的浓度相等
B. 电离平衡时,由于分子和离子的浓度不再发生变化,所以说电离平衡是静态平衡
C. 弱电解质达到电离平衡后,各种离子的浓度一定相等
D.电离平衡是相对的、暂时的、外界条件改变时,平衡就会发生移动
73.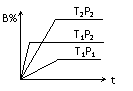 已知某可逆反应mA(g)+ nB(g) pC(g);⊿H?。在密闭容器中进行,下图表示在不同反应时间t、温度T和压强P与反应物B在混合气体中的百分含量B%的关系曲线,由曲线分析,下列判断正确的是(
)
已知某可逆反应mA(g)+ nB(g) pC(g);⊿H?。在密闭容器中进行,下图表示在不同反应时间t、温度T和压强P与反应物B在混合气体中的百分含量B%的关系曲线,由曲线分析,下列判断正确的是(
)
A、T1<T2、P1>P2、m+n>P1,⊿H <0;
B、T1>T2、P1<P2、m+n>P1、⊿H >0;
C、T1<T2、P1>P2、m+n<P1,⊿H <0;
D、T1>T2、P1<P2、m+n<P1、⊿H >0;
72. 已知某温度下的热化学方程式:2SO2(气)+O2(气) 2SO3;△H= -197KJ/mol,在同温同压下,向密闭容器中通入2molSO2和1molO2,达平衡时放出热量Q1KJ;向另一相同的密闭容器中通入1.5molSO2,0.75molO2和0.5molSO3,达平衡时放出热量Q2KJ。下列关系正确的是( )
A.Q1=Q2=197 B.Q1=Q2<197 C.Q1<Q2<197 D.Q2<Q1<197
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com