
题目列表(包括答案和解析)
3、下列关于二氧化硫的叙述中错误的是 ( )
A.在高温下二氧化硫可被催化氧化成三氧化硫 B.二氧化硫可使品红溶液褪色
C.二氧化硫既具有氧化性又具有还原性 D.二氧化硫与水反应生成硫酸
2、下列五种有色溶液与SO2作用均能褪色,其实质相同的是 ( )
①品红溶液;②酸性KMnO4溶液;③溴水;④滴有酚酞的NaOH溶液;
A.①④ B.①②③ C.②③ D.③④⑤
1、下列物质中硫元素只显示还原性的是 ( )
A.H2S B.SO2 C.S D.H2SO4
25. 将一定量的SO2和含0.65mol氧气的空气(忽略CO2)放入一定体积的密闭容器中,550℃时,在催化剂作用下发生反应:2SO2+O2 2SO3(正反应放热)。反应达到平衡后,将容器中的混合气体通过过量NaOH溶液,气体体积减少了19.04L;再将剩余气体通过某溶液吸收O2,气体的体积又减少了5.6L(以上气体体积均为标准状况下的体积)。请回答下列问题:
将一定量的SO2和含0.65mol氧气的空气(忽略CO2)放入一定体积的密闭容器中,550℃时,在催化剂作用下发生反应:2SO2+O2 2SO3(正反应放热)。反应达到平衡后,将容器中的混合气体通过过量NaOH溶液,气体体积减少了19.04L;再将剩余气体通过某溶液吸收O2,气体的体积又减少了5.6L(以上气体体积均为标准状况下的体积)。请回答下列问题:
(1)判断该反应达到平衡状态的标志是 。(填字母)
a.SO2和SO3浓度相等 b.SO2百分含量保持不变
c.容器中气体的压强不变 d.SO3的生成速率与SO2的消耗速率相等
(2)欲提高SO2的转化率,下列措施可行的是 。(填字母)
a.向装置中再充入N2 b.向装置中再充入O2
c.改变反应的催化剂 d.升高温度
(3)求该反应达到平衡时SO2的转化率(用百分数表示)。
(4)若将平衡混合气体的5%通入过量的BaCl2溶液,生成沉淀多少克?
24.实验室常利用甲醛法(HCHO)测定(NH4)2SO4样品中氮的质量分数,其反应原理为:
4NH4++6HCHO=3H++6H2O+(CH2)6N4H+[滴定时,l mol (CH2)6N4H+与1 mol H+相当],然后用NaOH标准溶液滴定反应生成的酸。某兴趣小组用甲醛法进行了如下实验:
步骤Ⅰ 称取样品1.400 g。
步骤Ⅱ 将样品溶解后,完全转移到250 mL容量瓶中,定容,充分摇匀。
步骤Ⅲ 移取25.00 mL样品溶液于250 mL锥形瓶中,加入10 mL20%的中性甲醛溶液,摇匀、静置5 min后,加入1-2滴酚酞试液,用NaOH标准溶液滴定至终点。按上述操作方法再重复2次。
⑴ 根据步骤Ⅲ填空:
① 碱式滴定管用蒸馏水洗涤后,直接加入NaOH标准溶液进行滴定,则测得样品中氮的质量分数__________(填“偏高”、“偏低”或“无影响”)。
② 锥形瓶用蒸馏水洗涤后,水未倒尽,则滴定时用去NaOH标准溶液的体积__________(填“偏大”、“偏小”或“无影响”)。
③ 滴定时边滴边摇动锥形瓶,眼睛应观察__________。
A.滴定管内液面的变化 B.锥形瓶内溶液颜色的变化
④ 滴定达到终点时,酚酞指示剂由__________色变成__________色。
⑵ 滴定结果如下表所示:
|
滴定次数 |
待测溶液的体积(/mL) |
标准溶液的体积 |
|
|
滴定前刻度(/mL) |
滴定后刻度(/mL) |
||
|
1 |
25.00 |
1.02 |
21.03 |
|
2 |
25.00 |
2.00 |
21.99 |
|
3 |
25.00 |
0.20 |
20.20 |
若NaOH标准溶液的浓度为0.1010 mo1·L-1,则该样品中氮的质量分数为__________。
23.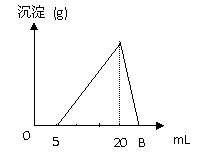 (6分)向20mL曾加过盐酸的AlCl3溶液中逐滴加入2mol·L-1的NaOH溶液,生成沉淀的质量与加入NaOH溶液体积如图:
(6分)向20mL曾加过盐酸的AlCl3溶液中逐滴加入2mol·L-1的NaOH溶液,生成沉淀的质量与加入NaOH溶液体积如图:
(1) 加入氢氧化钠溶液大于20mL以后溶液中发生
反应的离子方程式为
___________________________________________________。
(2)原溶液中c(Al3+)=_________mol·L-1,B点是__________mL。
22.(6分)在重铬酸钾(K2Cr2O7)溶液中存在如下平衡:
Cr2O72- +H2O 2HCrO4-
2HCrO4- 2CrO42-+2H+
2CrO42-+2H+
(1)向K2Cr2O7溶液中加入H2SO4溶液,则溶液中c(Cr2O72-)与c(CrO42-)的比值将______________填“增大”“减少”或“不变”)。
(2)向K2Cr2O7溶液中加入AgNO3溶液,发生离子互换反应,生成砖红色沉淀且溶液的pH下降,生成的砖红色沉淀的化学式为_________________。
(3)重铬酸钾在酸性溶液中是强氧化剂。例如它在H2SO4存在的条件下要把Fe2+离子氧化成Fe3+离子,本身被还原成Cr3+离子。该反应的离子方程式为:
__________________________________________________________________。
21.(6分)(1)浓度均为0.1mol / L的5种溶液:①NH4Cl,②NaHCO3,③CH3COOH,
④KCl,⑤NaOH溶液pH值由小到大的顺序是(填写编号):
____________________________________________________
(2)在纯碱溶液中滴入酚酞,溶液变红色,若在该溶液中再滴入过量的氯化钡溶液,所观察到的现象是____________________________________________________。其原因是(以离子方程式和简要的文字说明)__________________________________ _____________________________________________________________________
_______________________________________________________________。
20.(8分)反应2A  B+C在某一温度时,达到平衡。
B+C在某一温度时,达到平衡。
(1)温度升高,逆向移动,则正反应是_________热反应;
(2)若B是固体,降低压强时,平衡向左移动,则A是___________态;
(3)若A是气态,加压时,平衡不移动,则B为_______态,C为________态。
19.(8分)已知H2S溶液中存在着H2S H++HS-和HS-
H++HS-和HS- H++S2-的平衡;HCN是比H2S还弱的酸。当向H2S溶液中加入CuSO4时(生成CuS沉淀),H2S电离平衡 _________(正向或逆向)移动, c(H+)_______(减小或增大);当向溶液中加入NaCN,电离平衡_________(正向或逆向)移动, c(S2-)______(减小或增大)。
H++S2-的平衡;HCN是比H2S还弱的酸。当向H2S溶液中加入CuSO4时(生成CuS沉淀),H2S电离平衡 _________(正向或逆向)移动, c(H+)_______(减小或增大);当向溶液中加入NaCN,电离平衡_________(正向或逆向)移动, c(S2-)______(减小或增大)。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com