
题目列表(包括答案和解析)
1.下列各组物质中互为同素异形体的是
A.11H和12H B.CH3COOH和CH3OCH3 C. O2和O3 D.H2O和H2O2
26. ⑴ 向 2.0mL 浓度为 0.1mol / L 的 KCl 、KI 混合溶液中滴加1-2 滴0.01mol / L AgNO3 溶液,振荡,沉淀呈黄色,说明AgCl 的 Ksp 比AgI 的 Ksp (填“小”或“大”)。
⑵ 医药级二水合氯化钙(CaCl2·2H2O)样品中Cl-含量的测定方法是:a. 称取0.7500g样品,溶解,在250mL容量瓶中定容;b. 量取25.00mL待测溶液于锥形瓶中;c. 用0.05000mol / L AgNO3溶液滴定至终点,消耗AgNO3溶液体积的平均值是20.39mL 。
① 上述测定过程中需用溶液润洗的仪器是 ,如果在测定前没有润洗该仪器,测定结果(质量分数)会
(选填“偏大”、“偏小”或“无影响”)。
② 计算上述样品中CaCl2·2H2O的质量分数。

|

|
 版权所有:()
版权所有:()
版权所有:()
25.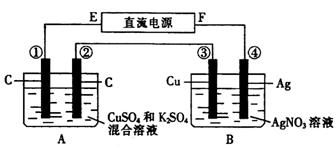 如图所示装置,通电 5min
后,第 ③ 极增重2.16 g ,同时在 A 池中收集到224 mL气体(标准状况下)。
如图所示装置,通电 5min
后,第 ③ 极增重2.16 g ,同时在 A 池中收集到224 mL气体(标准状况下)。
请回答下列问题:
⑴ E为 极;
⑵ 第 ② 极上产生的气体是 ,物质的量
为 ;
⑶ 写出第 ① 极上发生反应的电极反应式:
;
⑷ 设A池中原混合液的体积为200mL ,则通电前A池中原混合液中Cu2+的物质的量浓度为 。
24.(16 分)⑴ 在一定温度下,有下列反应发生:
Fe2O3 (s) + 3CO (g) 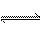 2Fe
(s) + 3CO2 (g)
2Fe
(s) + 3CO2 (g)
① 该反应的平衡常数表达式 K = 。
② 该温度下,在 2L 盛有 Fe2O3 粉末的密闭容器中通入 CO 气体,10min 后,生成了单质铁 11.2g 。则 10min 内 CO 的平均反应速率是 。
③ 请用上述反应中某种气体的有关物理量来说明该反应已达到平衡状态:
a. ;
b. 。
⑵ 在配制 FeCl3 溶液时,加入少许浓盐酸,其目的是:
;
不断加热 FeCl3 溶液,蒸干其水分并灼烧固体,最后得到的物质是 。
⑶ 已知:Fe2O3
(s) + 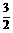 C(s) =
C(s) = 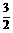 CO2 (g) + 2Fe(s)
CO2 (g) + 2Fe(s)
△H=+234.1kJ/mol
C (s) + O2 (g) = CO2 (g) △H=-393.5 kJ / mol
则 2Fe (s) + 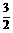 O2 (g) = Fe2O3 (s)的△H 是
。
O2 (g) = Fe2O3 (s)的△H 是
。
⑷ Fe (OH)2 在空气中短时间内可被氧化为 Fe (OH)3 ,发生的反应为:4Fe(OH)2+O2+2H2O = 4Fe(OH)3 ,下列说法中错误的是
(填字母)。
A. 该反应是能自发进行的反应
B. 该反应是熵增加的反应
C. 该反应是化合反应
D. 该反应是氧化还原反应
23.(10 分)反应
A (g) +
B (g)  C (g) +
D (g) 过程中的能量变化如下图所示,请回答下列问题:
C (g) +
D (g) 过程中的能量变化如下图所示,请回答下列问题:
⑴ 该反应是 (选填“吸热”、“放热”)反应;
⑵ 当反应达到平衡时,升高温度,A 的转化率 (选填“增大”、“减小”或“不变”),原因是:
;
⑶ 反应体系中加入催化剂对反应热是否有影响?原因是:
;
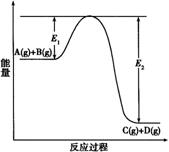 ⑷ 在反应体系中加入催化剂,
⑷ 在反应体系中加入催化剂,
反应速率增大,E1 和E2 的
变化是:E1 ,
E2 (选填“增
大”、“减小”或“不变”)。
22、(6分)恒温下,将a mol X与b mol Y的混合气体通入一个固定容积的密闭容器中,发生如下反应: X(g) + 3
Y(g) 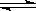 2Z(g)
(1)若反应达平衡前的某时刻t时,nt (X) = 13mol,nt (Z) = 6mol,计算a的值
2Z(g)
(1)若反应达平衡前的某时刻t时,nt (X) = 13mol,nt (Z) = 6mol,计算a的值
(2)反应达平衡时,混合气体的体积为716.8L(标况下),其中Z的含量(体积分数)为25%。计算平移时Z的物质的量。
21.(10分)某同学将一废旧电解单元槽改装成如图装置,其中间的膜可以自由更换。
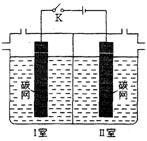 (1)若K处于打开状态,膜为半透膜(只允许离子和小分子自由通过且不易堵塞),Ⅰ室内加入KI淀粉溶液,
(1)若K处于打开状态,膜为半透膜(只允许离子和小分子自由通过且不易堵塞),Ⅰ室内加入KI淀粉溶液,
Ⅱ室内加入等体积的含有稀硫酸的双氧水,一段时间后可观察到的现象是 (填字母序号)
A.Ⅰ室内溶液变蓝
B.Ⅱ室内溶液变蓝
C.Ⅰ、Ⅱ室内溶液都变蓝
D.Ⅰ、Ⅱ室内溶液都不变蓝
(2)若膜为阳离子交换膜(只允许阳离子自由通过且不易堵塞),Ⅰ室内加入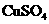 溶液,Ⅱ室内加入等体积NaCl溶液。K闭合后,开始一段时间内,Ⅰ室电极上的电极反应式为
,Ⅱ室电极上的电极反应式为
。
溶液,Ⅱ室内加入等体积NaCl溶液。K闭合后,开始一段时间内,Ⅰ室电极上的电极反应式为
,Ⅱ室电极上的电极反应式为
。
(3)若K处于打开状态,膜为阴离子交换膜(只允许阴离子自由通过且不易堵塞),Ⅰ室内加入0.1mol/L 溶液,Ⅱ室内加入0.1mol/L NaOH溶液,装置内发生反应的离子方程式为
。一段时间后,关闭K,则装置中Ⅰ室内产生的气体为 (填化学式)。
溶液,Ⅱ室内加入0.1mol/L NaOH溶液,装置内发生反应的离子方程式为
。一段时间后,关闭K,则装置中Ⅰ室内产生的气体为 (填化学式)。
20. (10分)化学学科中的平衡理论主要包括:化学平衡、电离平衡、水解平衡和溶解平衡四种,且均符合勒夏特列原理。请回答下列问题:
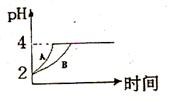 (1) 常温下,取 pH=2的盐酸和醋酸溶液各100mL, 向其中分别加入适量的Zn粒,反应过程中两溶液的pH变化如右图所示。则图中表示醋酸溶液中pH变化曲线的是
( 填“A”或“B”)。 设盐酸中加入的Zn质量为m1,醋酸溶液中加入的Zn质量为 m2。
(1) 常温下,取 pH=2的盐酸和醋酸溶液各100mL, 向其中分别加入适量的Zn粒,反应过程中两溶液的pH变化如右图所示。则图中表示醋酸溶液中pH变化曲线的是
( 填“A”或“B”)。 设盐酸中加入的Zn质量为m1,醋酸溶液中加入的Zn质量为 m2。
 则 m1 m2 ( 选填“<”、“=”、“>”)
则 m1 m2 ( 选填“<”、“=”、“>”)
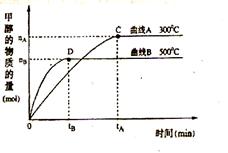
(2) 在体积为3L的密闭容器中,CO与H2在一定条件下反应生成甲醇:CO ( g) + 2H2( g) → CH3OH(g) 。反应达到平衡时,平衡常数表达式K= ,在500℃,从反应开始到平衡,氢气的平均反应速率v(H2)= 。
(3)25℃下, Mg(OH)2 (s)  Mg 2+ (aq) + 2OH -
( aq), Ksp = = 2×10 -11。在该温度下0.002 mol·L-1Mg SO4溶液里,调整溶液pH大于 ,有Mg (OH)2沉淀生成;
Mg 2+ (aq) + 2OH -
( aq), Ksp = = 2×10 -11。在该温度下0.002 mol·L-1Mg SO4溶液里,调整溶液pH大于 ,有Mg (OH)2沉淀生成;
(4) 常温下,某纯碱(Na2CO3) 溶液中滴入酚酞,溶液呈红色。则该溶液呈 性。在分析该溶液遇酚酞呈红色原因时,甲同学认为是配制溶液所用的纯碱样品中混有NaOH 所致;乙同学认为是溶液中Na2CO3电离出的CO32-水解所致。请你设计一个简单的实验方案给甲和乙两位同学的说法以评判(包括操作、现象和结论) 。
19.(8分)氨是氮循环过程中的重要物质,氨的合成是目前普遍使用的人工固氮方法。
 (1)已知:H-H键能为436
kJ/mol,N N键能为945 kJ/mol,N-H键能为391
kJ/mol。写出工业合成氨反应的化学方程式
;由键能计算合成氨反应(消耗1molN2 时)的△H =
。
(1)已知:H-H键能为436
kJ/mol,N N键能为945 kJ/mol,N-H键能为391
kJ/mol。写出工业合成氨反应的化学方程式
;由键能计算合成氨反应(消耗1molN2 时)的△H =
。
(2)氨是氮肥工业的重要原料。某化肥厂生产铵态氮肥(NH4)2SO4的工艺流程如下:
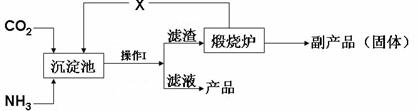
① 向沉淀池中加入CaSO4悬浊液后,需先通入足量NH3,再通入CO2的原因是 。操作Ⅰ的名称是 。
② 煅烧炉中产生的固态副产品为 ,生产流程中能被循环利用的物质X为 。
18.(8分) 现有A、B、C、D、E五种化合物,已知它们的阳离子是H+、、Na+、Al3+、Ag+、Ba2+,阴离子是OH--、Cl-、CO32-、NO3-、SO42--(各种离子不重复),进行如下实验:
① 测得溶液A、B呈碱性,溶液C、D、E呈酸性;
② 溶液A与溶液E反应有气体又有沉淀产生;溶液A与溶液C反应只有气体产生(沉淀包括微溶,下同)
③ 溶液D与另四种溶液反应都能产生沉淀;溶液C只能与溶液D反应产生沉淀。
试回答下列问题:
(1) 将溶液C逐滴加入等体积、等物质的量浓度的溶液A中,反应后溶液中各种离子浓度由大到小的顺序为
(2)E溶液与过量的溶液B反应的离子方程式
(3)已知: NaOH(aq) + H NO3(aq)=== Na NO3(aq) + H 2O(aq)△H=-akJ/mol
写出B和C的稀溶液反应的热化学方程式
(4)在100ml 0.1mol•L-1 E溶液中,逐滴加入35ml 2mol•L-1 NaOH溶液,最终得到沉淀物质的量为
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com