
题目列表(包括答案和解析)
13.下列关于电解质溶液的叙述正确的是 ( )
A. 常温下,pH=7的NH4Cl与氨水的混合溶液中离子浓度大小顺序为
c(Cl-)>c(NH4+)>c(H+)>c(OH-)
B. 将pH=4的醋酸溶液稀释后,溶液中所有离子的浓度均降低
C. 中和pH与体积均相同的盐酸和醋酸溶液,消耗NaOH的物质的量相同
D. 常温下,同浓度的Na2S与NaHS溶液相比,Na2S溶液的pH大
12.下列事实,不能用勒夏特列原理解释的是 ( )
A. 溴水中有下列平衡Br2 + H2O 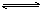 HBr + HBrO,当加入AgNO3溶液后,溶液颜色变浅
HBr + HBrO,当加入AgNO3溶液后,溶液颜色变浅
B. 对2HI(g) 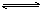 H2(g) + I2(g)
,平衡体系增大压强可使颜色变深
H2(g) + I2(g)
,平衡体系增大压强可使颜色变深
C. 反应CO + NO2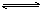 CO2 + NO(正反应为放热反应),升高温度可使平衡向逆反应方向移动
CO2 + NO(正反应为放热反应),升高温度可使平衡向逆反应方向移动
D. 合成NH3反应,为提高NH3的产率,理论上应采取低温度的措施(正反应为放热反应)
11.下列各组离子在指定的环境中能大量存在的是 ( )
A. 在pH=1的无色溶液中:SO42-、Cu2+、Na+、Cl-
B. 在能使紫色石蕊试纸变蓝色的溶液中:Na+、K+、S2-、CO32-
C. 在加入铝粉能产生H2的溶液中:NH4+、Na+、Fe2+、NO3-
D. 由水电离出的[H+]=1×10-12mol/L的溶液中:K+、Na+、Cl-、HCO3-
10. 判断下列盐类水解的叙述中正确的是 ( )
A. 溶液呈中性的盐一定是强酸、强碱生成的盐
B. 含有弱酸根盐的水溶液一定呈碱性
C. 盐溶液的酸碱性主要决定于形成盐的酸和碱的相对强弱
D.碳酸溶液中氢离子物质的量浓度是碳酸根离子物质的量浓度的两倍
9.下列有关滴定操作的顺序正确的是 ( )
①检查滴定管是否漏水 ②用蒸馏水洗涤玻璃仪器 ③用标准溶液润洗盛标准溶液的滴定管,用待测液润洗盛待测液的滴定管 ④装标准溶液和待测液并调整液面(记录初读数) ⑤取一定体积的待测液于锥形瓶中 ⑥滴定操作
A. ①③②④⑤⑥ B. ①②③④⑤⑥ C. ②③①④⑤⑥ D. ④⑤①②③⑥
8.将足量BaCO3粉末分别加入下列溶液中,充分溶解至溶液饱和。各溶液中Ba2+的浓度最小的为 ( )
A. 40mL 水 B. 10mL 0.2mol/LNa2CO3溶液
C. 50mL 0.01mol/L 氯化钡溶液 D. 100mL 0.01mol/L盐酸
7.把三氯化铁溶液蒸干灼烧最后得到的固体产物是 ( )
A. 无水三氯化铁 B. 氢氧化铁 C. 氯化亚铁 D. 三氧化二铁
6.下列各方程式中,属于水解反应的是 ( )
A. +H2O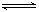 H2CO3+OH-
H2CO3+OH-
B. +H2O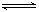 +H3O+
+H3O+
C. +OH-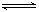 +H2O
+H2O
D. +H+=
5.用水稀释0.1mol/L氨水时,溶液中随着水量的增加而减小的是 ( )
A.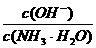 B.
B.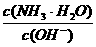 C.c(H+)和c(OH-)的乘积 D.OH-的物质的量
C.c(H+)和c(OH-)的乘积 D.OH-的物质的量
4.下列各组热化学方程式中,△H1>△H2的是 ( )
①C(s)+O2(g)===CO2(g) △H1 C(s)+O2(g)===CO(g) △H2
②S(s)+O2(g)===SO2(g) △H1 S(g)+O2(g)===SO2(g) △H2
③H2(g)+O2(g)===H2O(l) △H1 2H2(g)+O2(g)===2H2O(l) △H2
④CaCO3(s)===CaO(s)+CO2(g) △H1 CaO(s)+H2O(l)===Ca(OH)2(s) △H2
A. ① B. ④ C. ②③④ D. ①②③
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com