
题目列表(包括答案和解析)
9. 已知NaHSO3溶液呈酸性,NaHCO3溶液呈碱性。现有浓度均为0.1 mol/L的NaHSO3溶液和NaHCO3溶液,溶液中各种粒子的物质的量浓度的关系中(R表示S元素或C元素),一定正确的是
A.c(Na+) > c(HRO3-) > c(H+) > c(RO32-) > c(OH-)
B.c(HRO3-) + c(RO32-) + c(OH-) = c(H+) + c(Na+)
C.c(H+) + c(H2RO3) = c(OH-) + c(RO32-)
D.两溶液中c(Na+)、c(HRO3-)、c(RO32-)分别相等
8. 室温时,将x mL pH=a的稀NaOH溶液与ymL pH=b的稀盐酸充分反应。下列关于反应后溶液pH的判断,不正确的是
A.若x=y,且a+b=14,则pH=7 B.若10x=y,且a+b=13,则pH<7 k+s-5#u 
C.若ax=by,且a+b=13,则pH>7 D.若x=10y,且a+b=14,则pH>7
7. 室温时,取浓度相等的NaOH和HCl溶液,以3∶2体积比相混和,所得溶液的pH等于12,则原溶液的浓度为(忽略混合后溶液体积的变化)
A. 0.01mol/L B. 0.017mol/L C. 0.05mol/L D. 0.50mol/L
6. 向三份0.1mol/LCH3COONa溶液中分别加入少量NH4NO3、Na2SO3、FeCl3固体(忽略溶液体积变化),则CH3COO─浓度的变化依次为
A.减小、增大、减小
B.增大、减小、减小
k+s-5#u 
C.减小、增大、增大 D.增大、减小、增大
5. 室温时,由水电离的C(H+)=1×10-14mol·L-1的溶液中,一定能大量共存的离子组是
A.NH4+、Al3+、Br─、SO42─ B.Na+、K+、I─、NO3─
C.K+、Ba2+、C1─、NO3─ D.K+、Na+、SO42─、HCO3─
4. 相同条件下,等体积、等pH的醋酸和盐酸分别加水稀释后,溶液的pH仍相同,则所得溶液的体积k+s-5#u 
A.仍相同 B.醋酸大 C.盐酸大 D.无法判断
3. 下列物质的水溶液能导电,但不是电解质的是k+s-5#u 
①NH3;②H2S;③Cl2;④SO2;⑤Na2O;⑥NO2;⑦H2SO4
A.①③⑤ B.①②⑥⑦ C.①③④⑥ D.①③⑤⑥
2. 下列不属于低碳经济的是k+s-5#u

A.太阳能发电 B. 火力发电 C. 推广节能灯 D. 发展核电
1. 人体内的铁元素主要存在于哪个组织中
A.血液 B. 骨骼 C. 胃液 D. 肌腱k+s-5#u 
26. (10分)在某一容积为5 L的密闭容器内,加入 0.3 mol的CO和0.3 mol的H2O,在催化剂存在和800℃的条件下加热,发生如下反应:
(10分)在某一容积为5 L的密闭容器内,加入 0.3 mol的CO和0.3 mol的H2O,在催化剂存在和800℃的条件下加热,发生如下反应:
CO(g)+H2O(g) 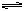 CO2(g)+H2(g);
CO2(g)+H2(g);
反应中CO2的浓度随时间变化情况如右图:
(1) 根据图上数据,反应开始至达到平衡时,CO的化学反应速率为
v(CO)= mol/(L·min);该温度下的平衡常数K= 。
(2) 不能作为判断该反应达到平衡的依据是________________。(填序号)
① CO、H2O、CO2、H2的浓度都相等 ②正、逆反应速率都为零
③ CO、H2O、CO2、H2的浓度都不再发生变化 ④混合气体的密度不再发生变化
(3) 如要一开始加入0.1 mol的CO、0.1 mol的H2O、0.2 mol的CO2和0.2 mol的H2,在相同的条件下,反应达平衡时,c(CO)=________________mol/L。
(4) 427℃时该反应的平衡常数为9.4,请结合(1)中的计算结果回答,如果升高温度该反应平衡向 方向移动。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com