
题目列表(包括答案和解析)
20.已知CH4(g)+2O2(g)→CO2(g)+2H2O(g) ΔH== -Q1 kJ/mol;
2H2(g)+O2(g) →2H2O(g) ΔH== -Q2 kJ/mol;
H2O(g) →H2O(l) ΔH== -Q3 kJ/mol
常温下,取体积比为4:1的甲烷和H2的混合气体112L(标准状况下),经完全燃烧后恢复到常温,则放出的热量为( )
A.4Q1+0.5Q2 B.4Q1+Q2+10Q3 C.4Q1+2Q2 D.4Q1+0.5Q2+9Q3
19.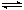 有平衡体系CO(g)+2H2(g) CH3OH(g) △H<0,为了增加甲醇的产量,提高经济效益,工厂应采取的正确措施是( )
有平衡体系CO(g)+2H2(g) CH3OH(g) △H<0,为了增加甲醇的产量,提高经济效益,工厂应采取的正确措施是( )
A.高温、高压 B.适宜温度、高压、催化剂
C.低温、低压 D.低温、高压、催化剂
18.一定条件下,可逆反应N2 +3H2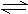 2NH3(正反应为放热反应)达到平衡,当单独改变下述条件后,有关叙述错误的是( )
2NH3(正反应为放热反应)达到平衡,当单独改变下述条件后,有关叙述错误的是( )
A.加催化剂,V正、V逆 都发生变化,且变化的倍数相等
B.加压,V正、V逆 都增大,且V正 增大的倍数大于V逆 增大的倍数
C.降温,V正、V逆 都减小,且V正 减小的倍数大于V逆 减小的倍数
D.增大氮气的浓度,V正、V逆 都增大,且V正 增大倍数大于V逆 增大倍数;N2 转化率减小,H2转化率增大
17.一定量的锌粉和6mol·L-1的过量盐酸反应,当改变下列条件时,能够减缓反应速率,又不影响产生H2总量的是( )
①锌粉改为锌粒 ②加几滴CuSO4溶液 ③填加硫酸钾溶液④填加硝酸锌溶液 ⑤填加浓盐酸 ⑥填加醋酸钠固体
A.①③④⑥ B.①③⑥ C.②④⑥ D. ③⑤⑥
16、在密闭容器中,可逆反应:nA(气)+mB(气)  pC(气) 处于平衡状态(已知m+n>p, ΔH>0)下列说法中正确的是( )
pC(气) 处于平衡状态(已知m+n>p, ΔH>0)下列说法中正确的是( )
①升高温度时,[B]/[C]的值减小;②降温时,体系内混合气体的平均摩尔质量减小;③加入B后,A的转化率变大;④加入催化剂,气体总物质的量不变;⑤充入C后,A,B的物质的量增大.
A.③④ B.②③⑤ C.①②⑤ D.全部
15. 对于可逆反应:2A(g)+B(g) 2C(g) △H<0,下列各图中正确的是( )
对于可逆反应:2A(g)+B(g) 2C(g) △H<0,下列各图中正确的是( )
14.密闭容器中,反应xA(g)+yB(g)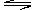 zC(g),达平衡时,A的浓度为0.5mol/L,若保持温度不变,将容器的容积扩大到原来的两倍,达到平衡时A的浓度降为0.3mol/L。下列判断正确的是( )
zC(g),达平衡时,A的浓度为0.5mol/L,若保持温度不变,将容器的容积扩大到原来的两倍,达到平衡时A的浓度降为0.3mol/L。下列判断正确的是( )
A.x+y<z B.平衡向正反应方向移动
C.B的转化率降低 D.C的体积分数增大
13.某温度下,把6molA和5molB两气体通入容积为1L的密闭容器中,一定条件下反应:
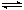 3A(g)+B(g) 2C(g)+xD(g) △H<0,5min达平衡,此时生成2molC,测得D的平均反应速率为0.2mol·(L·min)-1。下列说法中正确的是(
)
3A(g)+B(g) 2C(g)+xD(g) △H<0,5min达平衡,此时生成2molC,测得D的平均反应速率为0.2mol·(L·min)-1。下列说法中正确的是(
)
A.该温度下此反应的化学平衡常数K = 1
B.降低平衡体系的压强,逆反应速率变小,正反应速率增大,平衡正向移动
C.A的平均反应速率为0.6mol·(L·min)-1
D.x=2且B的转化率为25%
12.高温下,某反应达到平衡,化学平衡常数K=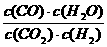 。恒容时,温度升高,H2浓度增大。下列说法正确的是( )
。恒容时,温度升高,H2浓度增大。下列说法正确的是( )
A.该反应化学方程式为CO+H2O 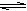 CO2+H2
B.升高温度,逆反应速率减小
CO2+H2
B.升高温度,逆反应速率减小
C.恒温恒容下,增大压强,H2浓度一定减小 D.该反应是焓变为负值
11. 某温度下的一固定容器中,发生如下反应
2E(g) F(g)+G(g)(正反应为吸热反应)若起始时E为a mol·L-1,F、G均为0,达平衡时E为0.5a mol·L-1;若E的起始浓度改为2a mol·L-1 ,F、G仍为0,当达到新的平衡时,下列说法不正确的是 ( )
某温度下的一固定容器中,发生如下反应
2E(g) F(g)+G(g)(正反应为吸热反应)若起始时E为a mol·L-1,F、G均为0,达平衡时E为0.5a mol·L-1;若E的起始浓度改为2a mol·L-1 ,F、G仍为0,当达到新的平衡时,下列说法不正确的是 ( )
A.新平衡下E的体积分数为50% B.新平衡下F的平衡浓度为0.5a mol·L-1
C.E的转化率后者比前者大 D.化学反应速率后者比前者快
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com