
题目列表(包括答案和解析)
2、关于铝的叙述正确的是
A.铝是地壳中含量最多的元素 B.铝能与强碱溶液反应放出氢气
C.铝能溶解于冷的浓硝酸中,氧化成硝酸铝 D.铝热反应中,铝的作用是氧化剂
1、铝属于①重金属;②轻金属;③常见金属;④稀有金属;⑤黑色金属;⑥有色金属
A.①②⑤ B.②④⑥ C.②③⑥ D.②④⑤
27.在2L密闭容器中加入适量的氮气和氢气,发生反应N2(g)+3H2(g)  2NH3(g) ,10min后,在密闭容器中达到平衡,平衡时n(N2)=3mol ,n(H2)=1 mol ,n(NH3)=4mol ,求:
2NH3(g) ,10min后,在密闭容器中达到平衡,平衡时n(N2)=3mol ,n(H2)=1 mol ,n(NH3)=4mol ,求:
(1)N2的转化率和这段时间内NH3的化学反应速率
(2)平衡时压强与开始时压强的比值
(3)该温度下反应的平衡常数.
0.5mol/L、2mol/L、18.4mol/L),设计实验
方案来研究影响反应速率的因素。
(1)甲同学研究的实验报告如下表:
|
实 验 步 骤 |
现 象 |
结 论 |
|
①分别取等体积的2
mol/L硫酸于试管中; ②分别投入大小、形状相同的Cu、Fe、Mg。 |
反应快慢: Mg>Fe>Cu |
反应物的性质越活泼,反应速率越快。 |
该同学的实验目的是研究__________________________________对反应速率的影响;
 根据控制变量法,要得出正确的实验结论,还需控
根据控制变量法,要得出正确的实验结论,还需控
制的实验条件是保持 相同。
(2)乙同学为了更精确地研究浓度对反应速率的影响,
利用右图装置进行定量实验。完成该实验应选用的实验药
品是 ;应该测定的实验数据是________________________。
26、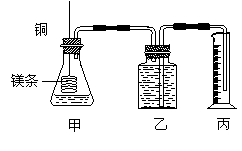 影响化学反应速率的因素很多,某课外兴趣小组用实验的方法进行探究。
影响化学反应速率的因素很多,某课外兴趣小组用实验的方法进行探究。
学生利用Cu、Fe、Mg和不同浓度的硫酸
25.用100mL0.50mol/L盐酸与100mL0.55mol/LNaOH溶液在如图所示的装置中进行中和反应。通过测定反应过程中所放出的热量可计算中和热。回答下列问题:
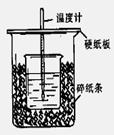 (1)从实验装置上看,图中尚缺少的一种玻璃用品
(1)从实验装置上看,图中尚缺少的一种玻璃用品
是 。
(2)大烧杯上如不盖硬纸板和烧杯间不填满碎纸条,
求得的中和热数值 (填“偏大、偏小、无影响”)
(3)如果用120mL0.50mol/L盐酸与100mL0.55mol/LnaOH
溶液进行反应,与上述实验相比,所放出的热量 (填“相等、不相等”),所求中和热 (填“相等、不相等”)
(4)用相同浓度和体积的氨水(NH3·H2O)代替NaOH溶液进行上述实验,测得的中和热的数值会 ;(填“偏大”、“偏小”、“无影响”)。
24.在某一容积为5 L的密闭容器内,加入 0.3 mol
的CO和0.3 mol的H2O,在催化剂存在和800℃的条
件下加热,发生如下反应:CO(g)+H2O(g) 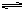 CO2(g)
CO2(g)
+H2(g) ΔH>0,反应中CO2的浓度随时间变化情况如
右图:
(1) 根据图上数据,反应开始至达到平衡时,CO的
化学反应速率为v(CO)=___ mol/(L·min),反应达平衡时,C(H2)=_________mol/L,该温度下的平衡常数K= 。
 (2)在体积不变的条件下,改变下列条件重新达到平衡时能使平衡常数K增大的有
(2)在体积不变的条件下,改变下列条件重新达到平衡时能使平衡常数K增大的有
(填字母)
A.升高温度 B.降低温度 C.增大压强
D.减小压强 E.加入催化剂 G.移出一氧化碳气体
(3) 如要一开始加入0.1 mol的CO、0.1 mol的H2O、0.2 mol的CO2和0.2 mol的H2,在相同的条件下,反应达平衡时,c(CO)=________________mol/L.
(4)加入等物质的量的CO和H2O在催化剂存在和800℃的条件下加热使之反应,在某一时刻测得C(CO )= 0.1mol/L,C(CO2 )= 0.2mol/L ,则此反应是否处于平衡状态:
(填“是”或“否”),若没有处于平衡状态则该反应向 移动。(填“正方向”或“逆方向”)
23.一密闭容器中发生下列反应N2+3H2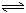 2NH3 ΔH<0,下图是某一时间段中反应速率与反应进程的曲线关系图。回答下列问题:
2NH3 ΔH<0,下图是某一时间段中反应速率与反应进程的曲线关系图。回答下列问题:
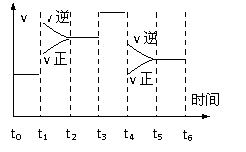 (1)处于平衡状态的时间段是_____________________
(1)处于平衡状态的时间段是_____________________
(填一处时间段即可)
(2)t1、t3、t4时刻,体系中分别是什么条件发生了什么
变化?_____________________、_____________________、
_____________________。
(3)下列时间段中,氨的百分含量最高的是( )
 A.t0-t1
B.t2-t3
C.t3-t4
D.t5-t6
A.t0-t1
B.t2-t3
C.t3-t4
D.t5-t6
22、
在一定条件下,可逆反应:mA+nB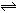 pC达到平衡,若:
pC达到平衡,若:
(1) A、B、C都是气体,减少压强,平衡向正反应方向移动,则m+n p(填“ > 、< 或 =”)
(2) A、C是气体,若增加B的量,平衡不移动,则B应为 态;
(3) A、C是气体,而且m+n = p,增大压强可使平衡发生移动,则平衡移动的方向必是向 移动。(填“正方向”或“逆方向”)
(4) 加热后,可使C的质量增加,则正反应是 反应(选填“放热”或“吸热”)。
21.依据条件,写出下列反应的热化学方程式。
(1)在25℃、101kPa下,1g甲醇燃烧生成CO2和液态水时放热22.68kJ。则表示甲醇燃烧热的热化学方程式为_________ _________________________
(2)在25℃、101kPa下,2.3g某液态有机物(其摩尔质量为46g/mol)和过量的氧气混合点燃,恰好完全燃烧,生成2.7g水和0.1molCO2并放出68.35kJ热量,则该反应的热化学方程式是
(3)在25℃、101kPa下,在C2H2完全燃烧生成CO2和液态水的反应中,每5mol电子转移时,放出650kJ的热量,则该反应的热化学方程式是_________________________________
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com