
题目列表(包括答案和解析)
31.(6分)在一定体积的密闭容器中,进行如下化学反应:
CO2(g)+H2(g) CO(g)+H2O(g),其化学平衡常数K和温度t的关系如下表:
CO(g)+H2O(g),其化学平衡常数K和温度t的关系如下表:
|
t℃ |
700 |
800 |
830 |
1000 |
1200 |
|
K |
0.6 |
0.9 |
1.0 |
1.7 |
2.6 |
回答下列问题:
(1)该反应的化学平衡常数表达式为K = 。
(2)该反应为 反应(选填“吸热”、“放热”)。
(3)830℃时,容器中的反应已达到平衡。在其他条件不变的情况下,扩大容器的体积。平衡 移动(选填“向正反应方向”、“向逆反应方向”、“不”)。
(4)若 830℃时,向容器中充入1mol CO、5mol H2O,反应达到平衡后,其化学平衡常数K 1.0(选填“大于”、“小于”、“等于”)
(5)若1200℃时,在某时刻平衡体系中CO2、H2、CO、H2O的浓度分别为2 mol·L-1、
2 mol·L-1、4 mol·L-1、4 mol·L-1,则此时上述反应的平衡移动方向为 。(选填“正反应方向”、“逆反应方向”、“不移动”)
30.(12分)下图所示装置中,甲、乙、丙三个烧杯依次分别盛放100g 5.00%的NaOH溶液、足量的CuSO4溶液和l00g 10.00%的K2SO4溶液.电极均为石墨电极。

(1)接通电源,经过一段时间后,测得丙中K2SO4浓度为10.37%,乙中c电极质量增加。据此回答问题: ①电源的N端为 极。 ②电极b上发生的电极反应为 。
③电解前后甲溶液 pH ;乙溶液 pH ;丙溶液 pH 。(填“增大”、“减小”或“不变”)
④电极b上生成的气体在标准状况下的体积 ;电极c的质量变化是 g。
(2)写出乙溶液中的电解反应方程式:
。
29.(4分)(1)常温下,设pH 均为5的H2SO4和A12(SO4)3溶液中由水电离出的c(H+)分别为c1 、c2,则c1/c2= 。
(2)常温下,pH=13的Ba(OH)2溶液aL与PH=3的H2SO4溶液bL混合(混合后溶液体积变化忽略不计)。若所得混合溶液PH=12,则a:b= 。
28.已知:为使Fe3+、Fe2+、Zn2+较完全的形成氢氧化物沉淀,溶液的pH应分别为3.7、9.6、4.4左右。某硫酸锌酸性溶液中含有少量Fe3+、Fe2+,为除去这些离子制得纯净的硫酸锌,应加入的试剂是( )
A.NaOH溶液 B.氨水 C.KMnO4、ZnCO3 D.H2O2、ZnO
27.常温下,下列溶液中各离子浓度关系正确的是( )
A.等物质的量的氨水和盐酸混合后的溶液:c(H+)=c(OH-)+c(NH3·H2O)
B.浓度为0.1 mol·L-1的碳酸钠溶液:c(Na+)=2c(CO32-)+c(HCO3-) +c(H2CO3)
C.pH=12的氨水溶液与pH=2的盐酸等体积混合:c(Cl-)>c(NH4+)>c(H+)>c(OH-)
D.醋酸溶液与NaOH溶液相混合后,所得溶液呈中性:c(Na+)>c(CH3COO-)
26.有物质的量浓度均为0.1mol·L-1 的① Na2CO3溶液 ② CH3COONa溶液 ③ NaOH溶液各25mL,,下列说法正确的是 ( )
A.3种溶液pH的大小顺序是 ③>②>①
B.若将3种溶液稀释相同倍数,pH变化最大的是②
C.若分别加入25mL 0.1mol·L-1盐酸后,pH最大的是①
D.若升高温度,则②的pH减小
25.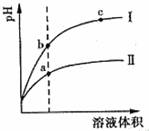 某温度下,相同pH值的盐酸和醋酸溶液分别加水稀释,pH随溶液体积变化的曲线如右图所示。据图判断正确的是( )
某温度下,相同pH值的盐酸和醋酸溶液分别加水稀释,pH随溶液体积变化的曲线如右图所示。据图判断正确的是( )
A.II为盐酸稀释时的pH值变化曲线 B.b点溶液的导电性比c点溶液的导电性强 C.a点KW的数值比c点Kw的数值大 D.b点酸的总浓度大于a点酸的总浓度
24. 一种新型的燃料电池,它以多孔镍板为电极插入KOH溶液中,然后分别向两极通入乙烷和氧气,其总反应式为:2C2H6+7O2+8KOH 4K2CO3+10H2O,有关此电池的推断正确的是( )
一种新型的燃料电池,它以多孔镍板为电极插入KOH溶液中,然后分别向两极通入乙烷和氧气,其总反应式为:2C2H6+7O2+8KOH 4K2CO3+10H2O,有关此电池的推断正确的是( )
A.每消耗1mol C2H6,则电路上转移的电子为14 mol
 B.负极反应为7O2+14 H2O+28e- 28OH-
B.负极反应为7O2+14 H2O+28e- 28OH-
C.放电一段时间后,负极周围的pH升高
D.放电过程中KOH的物质的量浓度不变
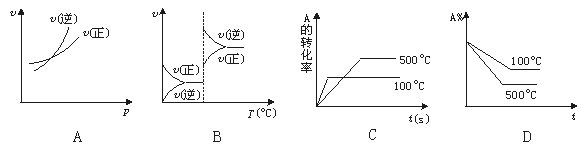
23.对于可逆反应A(g)+2B(g) 2C(g) ΔH﹥0,下列图象中正确的是( )
2C(g) ΔH﹥0,下列图象中正确的是( )
|
|
|
|
22.相同温度下,100mL 0.01 mol·L-1的醋酸溶液与10mL 0.1 mol·L-1的醋酸溶液相比较,下列数值前者大于后者的是( )
A.中和时所需NaOH的量 B.c(H+)
C.c(OH-) D.c(CH3COOH)
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com