
题目列表(包括答案和解析)
15.
 某温度下,已知反应mX(g)+nY(g) qZ(g)△H>O,m+n>q,在体积一定的密闭容器中达到平衡,下列叙述正确的是( )
某温度下,已知反应mX(g)+nY(g) qZ(g)△H>O,m+n>q,在体积一定的密闭容器中达到平衡,下列叙述正确的是( )
A.反应速率v正(X)=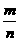 v逆(Y) B.加入X,反应的△H增大
v逆(Y) B.加入X,反应的△H增大
C.增加Y的物质的量,X的转化率增大 D.降低温度,平衡向正反应方向移动
14.某电解池内盛有某电解质溶液,插入两根电极,通电后欲达到下列要求:①阳极质量不变②阴极质量增加③电解液pH变小。则可选用的电极材料和电解质溶液是( )
A.铂做阳极、铜做阴极,电解硫酸铜溶液
B.石墨做阳极和阴极,电解硫酸
C.铜做阳极、铁做阴极,电解氯化铜溶液
D.铜做阳极、铜做阴极,电解硫酸铜溶液
13.下列说法正确的是( )
A.氢镍碱性电池原理为H2+2NiO(OH)==2Ni(OH)2,则该电池负极反应式为:
H2-2e-+20H-==2H20
B.热化学方程式中的计量系数既可以表示物质的量,也可以表示分子个数。
C.已知1g氢气燃烧生成水蒸气放出120. 9kJ的热,水蒸气分解的热化学方程式为:2H20(g)==2H2(g)+02(g);△H=-483.6kJ·mol。
D.已知S(s)+02(g)=S02(g);△H1
S(g)+02(g)==SO2(g);△H2,则△H1<△H2
12.
 常温常压下,在带有相同质量活塞的容积相等的甲、乙两容器里,分别充有二氧化氮和空气,现分别进行下列两实验:(N204 2NO2△H>O)(a)将两容器置于沸水中加热;(b)在活塞上都加2kg的砝码。在以上两情况下,甲和乙容器的体积大小的比较,正确的是( )
常温常压下,在带有相同质量活塞的容积相等的甲、乙两容器里,分别充有二氧化氮和空气,现分别进行下列两实验:(N204 2NO2△H>O)(a)将两容器置于沸水中加热;(b)在活塞上都加2kg的砝码。在以上两情况下,甲和乙容器的体积大小的比较,正确的是( )
A.(a)甲>乙,(b)甲>乙
B.(a)甲>乙,(b)甲=乙
C.(a)甲<乙,(b)甲>乙
D.(a)甲>乙,(b)甲<乙
11.已知:C(s,金刚石)=C(s,石墨) △H=-1.9 kJ·mol。
C(s,金刚石)+02(g)=CO2(g) △H1
C(s,石墨)+02(g)=CO2(g) △H2
根据已述反应所得出的结论正确的是( )
A.△H1=△H2 B.△H1<△H2
C.△H1>△H2 D.石墨比金刚石稳定
10.
 在密闭容器中进行如下反应:X2(g)+Y2(g) 2Z(g),已知X2、Y2、Z的起始浓度分别为0.1mol·L-1、0.3mol·L-1、0.2mol·L-1,在一定条件下,当反应达到平衡时,各物质的浓度有可能是( )
在密闭容器中进行如下反应:X2(g)+Y2(g) 2Z(g),已知X2、Y2、Z的起始浓度分别为0.1mol·L-1、0.3mol·L-1、0.2mol·L-1,在一定条件下,当反应达到平衡时,各物质的浓度有可能是( )
A.Y2为0.2mol·L-1 B.Y2为0.35mol·L-1
C.X2为0.2mol·L-1 D.Z为0.4mol·L-1
9.下列有关电化学知识的描述中正确的是( )
A.原电池的正极和电解池的阳极均发生氧化反应
B.氢燃料电池把氢气在氧气中燃烧放出的热能转化为电能
C.镀层破损后,白铁(镀锌的铁)比马口铁(镀锡的铁)耐腐蚀
D.铅蓄电池充电时电源的正极接蓄电池标“-”的一极
8.下列关于实验现象的描述不正确的是( )
A.把铜片和铁片紧靠在一起浸入稀硫酸中,铜片表面出现气泡
B.用铜片做阳极,铁片做阴极,电解氯化铜溶液,铁片表面出现一层铜
C.把铜片插入三氯化铁溶液中,在铜片表面出现一层铁
D.把铁片敢入盛有盐酸的试管中,加入几滴氯化铜溶液,气泡放出速率加快
7.
 对于2SO2+O2 2S03,△H<O的反应,下列说法中正确的是( )
对于2SO2+O2 2S03,△H<O的反应,下列说法中正确的是( )
A.当SO2和SO3的浓度相等时,反应达到化学平衡状态
B.当生成SO:的速率与生成SO,的速率相等时,反应达到化学平衡状态
C.温度一定,若SO2、O2、SO3的起始浓度不同,反应达到平衡时,SO3的平衡浓度一定也不同
D.只有当外界条件改变,使 ,才能引起上述化学反应的平衡状态发生移动
,才能引起上述化学反应的平衡状态发生移动
6.


 设C+CO2
2C0(吸热反应)反应速率为v1,N2+3H2 2NH3(放热反应)反应速率为v2。对于上述反应,升高温度时, v1和v2的变化情况为( )
设C+CO2
2C0(吸热反应)反应速率为v1,N2+3H2 2NH3(放热反应)反应速率为v2。对于上述反应,升高温度时, v1和v2的变化情况为( )
A.都增大 B.都减小
C.v1增大,v2减小 D.v1减小,v2增大
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com