
题目列表(包括答案和解析)
15.(4分)H2S有毒,可杀虫;医疗上可以用Na2S的水溶液洗患处来治疗由一种小芥虫在皮肤内生活引起的皮肤病,而且用热水配制的Na2S溶液治疗效果更好。写出有关的离子方程式: ;
用热水配制的原因: 。
14.为了配制NH4+的浓度与Cl-的浓度比更接近1:1的溶液,可在NH4Cl溶液中加入
A.适量的HCl B.适量的H2SO4 C.适量的氨水 D.NaOH
第Ⅱ卷 非选择题(共54分)
13.下列各组离子,在指定环境中一定能大量共存的是
A. 在pH>7的溶液中, Na+、K+、Cl-、CH3COO-
B. 在pH<7的溶液中, Na+、K+、S2-、HCO3-
C. 由水电离出来的 c(H+)=10-12 mol/L的溶液中, NH4+、K+、CO32-、Cl-
D. 在pH=0的溶液中, Fe3+、Al3+、SO42-、Cl-
12.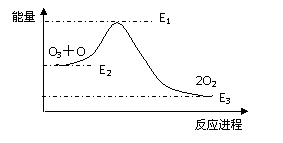 氯原子对O3分解有催化作用:
氯原子对O3分解有催化作用:
Cl+O3=ClO+O2 ΔH1
ClO+O=Cl+O2 ΔH2
大气臭氧层的分解反应是:O+O3=2O2 ΔH,
该反应的能量变化示意图如右图,下列叙述中,正确的是
A.反应O+O3=2O2的 ΔH=E1-E3 B.O+O3=2O2是放热反应
C.ΔH=ΔH1 +ΔH2 D.大气层中的臭氧无法再生
11. 下列各组物质的颜色变化,可用勒夏特列原理解释的是
A.光照氯水,颜色变浅
B.向盛有NO2的集气瓶中投入活性炭,颜色变浅
C.加热氯化铁溶液,溶液变浑
D.压缩H2与I2(g)反应的平衡混合气体,颜色变深
10.在0.1mol/L的NaHS溶液中有关微粒浓度的关系正确的是
A. c(Na+) > c(HS-) > c(S2-) > c(H+) > c(OH-)
B. c(Na+) > c(S2-) > c(OH-) > c(HS-) > c(H+)
C. c(Na+) = c(HS-) + 2 c(S2-) + c(OH-)
D. c(Na+) = c(HS-) + c(S2-) + c(H2S)
9.某温度(t℃)时,测得水的Kw=10-13。在此温度下,将pH=12的NaOH溶液VaL与pH=2的H2SO4溶液VbL混合。所得混合液的pH=10,则Va︰Vb为
A.1︰10 B.10︰1 C.1︰9 D. 9︰1
8.某溶液中由水电离产生的c(H+)等于10-10mol/L,该溶液的溶质不可能是
A.Ca(OH)2 B.HCl C.NH3·H2O D.CH3COONa
7.可以充分说明反应2P(g)+Q (s) 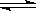 R (g) + N (g) 在恒温恒容下已达到平衡的是
R (g) + N (g) 在恒温恒容下已达到平衡的是
A. 反应容器内的密度不随时间改变
B. 反应容器内P、Q、 R、 N四者共存
C. P的生成速率和N的生成速率相等
D. 反应容器内气体总物质的量不随时间变化
6.某温度下反应N2O4(g)  2NO2(g) ΔH>0,在密闭容器中达到平衡,下列说法不正确的是
2NO2(g) ΔH>0,在密闭容器中达到平衡,下列说法不正确的是
A.缩小体积,将使正反应速率增大
B.体积保持不变,加入少量NO2,将使正反应速率减小
C.体积保持不变,加入N2O4,再达到平衡时颜色加深
D.体积保持不变,升高温度,再达到平衡时颜色加深
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com