
题目列表(包括答案和解析)
5.下列化合物中含2个“手性碳原子”的是 ( )
A.OHC--OH B.OHC--
 C.HOOC-- D. -
C.HOOC-- D. -
4. Na2O2、HCl和Al2O3在水中反应,若最后所得溶液中只含AlO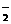 、Na+、Cl-而不含Al3+,且忽略NaAlO2的水解,则Na2O2、HCl和Al2O3的物质的量之比为
( )
、Na+、Cl-而不含Al3+,且忽略NaAlO2的水解,则Na2O2、HCl和Al2O3的物质的量之比为
( )
A.4∶6∶1 B.8∶6∶1
C.3∶3∶1 D.4∶6∶3
3.把一块Al、Fe合金放入足量盐酸中,通入足量的Cl2 ,再加过量NaOH 溶液、过滤,把滤渣充分灼烧,得到固体残留物恰好与原合金质量相等,则合金中Fe、Al质量比为( )
A.1: 1 B.3: 1 C.1: 4 D.7: 3
2.为了除去MgCl2酸性溶液中的Fe3+,可在加热搅拌的条件下加入一种试剂,过滤后再加入适量盐酸。这种试剂是:( )
A.NH3×H2O B.NaOH C.Na2CO3 D.MgCO3。
1.将固体x投入足量y中,能生成白色沉淀并放出一种无色气体,该气体不溶于水并能燃烧,则x和y可能是( )
A.Fe和H2SO4 B.Na和AlCl3溶液
C.Mg3N2 和水 D.Al粉和NaOH 溶液
20.(10分)已知:反应①Fe(s)+CO2(g)  FeO(s)+CO(g) 平衡常数为K1
FeO(s)+CO(g) 平衡常数为K1
反应②Fe(s)+H2O(g)
 FeO(s)+H2(g) 平衡常数为K2
FeO(s)+H2(g) 平衡常数为K2
反应③H2(g)+CO2(g)  H2O(g)+CO(g) 平衡常数为K3
H2O(g)+CO(g) 平衡常数为K3
测得在不同温度下,K1、K2值如下:
|
温度/℃ |
K1 |
K2 |
|
500 |
1.00 |
3.15 |
|
700 |
1.47 |
2.26 |
|
900 |
2.40 |
1.60 |
(1)若500℃时进行反应①,CO2起始浓度为2mol.L-1,CO2转化率为 。
(2)反应②的焓变△H 0(填>、<、=)。
(3)700℃反应②达到平衡,使得该平衡向右移动,其它条件不变时,可以采取的措施有 (填序号)
A.缩小反应器体积 B.加入水蒸气
C.升高温度到900℃ D.使用合适的催化剂
 (4)下列图像符合反应①的是
(填序号)(图中v是速率、∅为混合物中CO含量,T为温度)
(4)下列图像符合反应①的是
(填序号)(图中v是速率、∅为混合物中CO含量,T为温度)
(5)900℃进行反应③H2(g)+CO2(g)  H2O(g)+CO(g),其平衡常数K3的数值为
H2O(g)+CO(g),其平衡常数K3的数值为
19. (14分) 如图,外接电源为Zn-MnO2干电池,甲乙为相互串联的两个电解池,请回答:
如图,外接电源为Zn-MnO2干电池,甲乙为相互串联的两个电解池,请回答:
(1)甲池若为用电解原理精炼铜的装置, B极是 极,材料是 , 电极反应式为 ,电解质溶液为 。
(2)乙池中若滴入少量酚酞试液,开始一段时间后,Fe极附近呈 色。
(3)Zn-MnO2干电池应用广泛,其电解质溶液是ZnCl2-NH4Cl混合溶液。该电池的负极材料是 。电池工作时,电子流向 (填“正极”或“负极”)。
(4)若ZnCl2-NH4Cl混合溶液中含有杂质Cu2+,会加速某电极的腐蚀,其主要原因是 。欲除去Cu2+,最好选用下列试剂中的 (填代号)。
a.NaOH b.Zn c.Fe d.NH3·H2O
(5)MnO2的生产方法之一是以石墨为电极,电解酸化的MnSO4溶液。阴极的电极反应式是
。若电解电路中通过2mol电子,MnO2的理论产量为 g。(已知:相对原子质量 Mn-55 O-16)
18.(9分)某学生用0.2000mol·L-1的标准NaOH溶液滴定未知浓度的盐酸,其操作可分为如下几步:
① 用蒸馏水洗涤碱式滴定管,并注入NaOH溶液至“0”刻度线以上
② 固定好滴定管并使滴定管尖嘴充满液体
③ 调节液面至“0”或“0”刻度线稍下,并记下读数
④ 量取20.00mL待测液注入洁净的锥形瓶中,并加入3滴酚酞溶液
⑤ 用标准液滴定至终点,记下滴定管液面读数。
请回答:
(1) 以上步骤有错误的是(填编号) ,该错误操作会导致测定结果(填“偏大”、“偏小”或“无影响”)
 (2)用标准NaOH溶液滴定时,应将标准NaOH溶液注入
中。(从下图中选填“甲”或“乙”)
(2)用标准NaOH溶液滴定时,应将标准NaOH溶液注入
中。(从下图中选填“甲”或“乙”)
(3) 下列操作会引起实验结果偏大的是: (填编号)
A.在锥形瓶装液前,留有少量蒸馏水
B.滴定前,滴定管尖嘴有气泡,滴定后无气泡
C.锥形瓶用蒸馏水洗涤后,未用待测液润洗
D.用酸式滴定管量取液体时,释放液体前滴定管前端有气泡,之后消失
(4) 判断到达滴定终点的现象是:锥形瓶中溶液 。
(5) 以下是实验数据记录表
|
滴定次数 |
盐酸体积mL |
NaOH溶液体积读数(ml) |
|
|
滴定前 |
滴定后 |
||
|
1 |
20.00 |
0.00 |
21.30 |
|
2 |
20.00 |
0.00 |
16.30 |
|
3 |
20.00 |
0.00 |
16.22 |
通过计算可得,该盐酸浓度为: mol·L-1(计算结果保留4位小数)
17.(11分)25℃时,将0.01molCH3COONa和0.002molHCl溶于水,形成1L混合溶液
(1)该溶液中存在着三个平衡体系,用电离方程式或离子方程式表示:
A
B
C
(2)溶液中共有 种不同的粒子
(3)在这些粒子中,浓度为0.01mol/L的是 ;浓度为0.002mol/L的是 。
(4) 和 两种粒子物质的量之和等于0.01mol。
16.(6分)
A.已知:CH4(g)+2O2(g)== CO2(g)+2H2O(l);ΔH=-Q1 kJ· ,
,
2H2(g)+O2(g)
=2H2O(g);△H2=-Q2
kJ· ,
,
2H2(g)+O2(g)=2H2O(l);△H2=-Q3
kJ· 。
。
常温下,取体积比4∶1的甲烷和氢气的混合气体11.2L(标准状况下),经完全燃烧后恢复至室温,则放出的热量为 kJ 。
B.NH3(g)燃烧生成NO2 (g)和H2O(g),已知
(1)2H2 (g)+O2 (g)=2H2O(g) ΔH=-480 kJ/mol
(2) N2 (g)+2O2 (g)=2NO2 (g) ΔH=+68 kJ/mol
(3) N2 (g)+3H2 (g)=2NH3(g) ΔH=-92 kJ/mol
NH3(g)燃烧生成NO2 (g)和H2O(g) 的热化学方程式为
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com