
题目列表(包括答案和解析)
2.答案:(1)广口瓶 药匙 镊子 平放 容器口 慢慢竖起 缓缓滑落到容器底部 固体粉末粘在试管壁上 倾斜 药匙(或纸槽) 试管底部 直立
(2)细口瓶 倒 朝向手心 挨着 量筒 水平 凹液面的最低处 胶头滴管 竖直正上方
1.答案:(1)用手接触药品 把鼻孔凑到容器口去闻药品的气味 尝任何药品的味道
(2)1-2毫升 盖满试管底部
(3)放回原瓶 随意丢弃 拿出实验室 放入指定的容器内
2.取用方法
(1)固体药品的取用:固体药品通常保存在里,取用固体药品一般用____________,有些块状的药品可用________________________夹取。
块状固体:装入试管时应做到“一横二放三滑”。把密度较大的块状固体或金属颗粒放入玻璃容器时,应先把容器_______________,把药品或金属颗粒放入_______________以后,再把容器_______________,使药品或金属颗粒_______________,以免打破容器。
粉末状固体:取用时应注意“一斜二送三直立”。往试管里装入固体粉末时,为避免_______________,可先使试管_______________,把盛有药品的_______________小心地送至_______________,然后使试管_______________。
(2)液体药品的取用:液体药品通常保存在_______________里。
倾倒:取下瓶塞 放在实验台上,标签要_______________,瓶口_______________试管口。
量取:取用一定量的液体药品,常用_______________量出体积。量液时,量筒必须_______________放置,视线要与_______________保持水平,再读出液体的体积。
滴加:取用少量液体时还可用_____________,滴加时应将胶头滴管放于容器口___________。
1.取用原则
(1)“三不原则”:不能____________,不要____________,不得____________。
(2)节约原则:要严格按照实验规定的用量取用药品。如果没有说明用量,一般取最少量:液体取________________________,固体只要________________________。
(3)处理原则:用剩的药品应做到“三不要一要”:不要____________,不要____________,不要____________,要____________。
2.了解溶液酸碱度的意义
(1)酸碱性与化工生产的关系
化工生产中许多反应必须在一定pH溶液中才能进行。
(2)酸碱性与农作物生长的关系
下表是几种农作物最适宜生长的pH范围:
|
作物 |
水稻、小麦、玉米 |
番茄、西瓜 |
棉花 |
大豆 |
甘蔗、桑树、苹果树 |
松树、烟草 |
柑橘树 |
茶树 |
|
pH |
6.0-7.0 |
6.0-7.0 |
6.0-6.8 |
6.5-7.5 |
6.0-8.0 |
5.0-6.0 |
5.0-7.0 |
5.0-5.5 |
不难看出,大多数农作物最适宜在接近中性(pH在6.5-7.5之间)的土壤中生长。有些地区是酸雨的多发区,导致土壤酸化,不利于农作物生长;还有些地区属于盐碱地,土壤显碱性,也不利于农作物生长。
(3)雨水的pH与空气污染的关系
正常的雨水pH约为5.6,显弱酸性,是因为空气中二氧化碳溶入其中形成碳酸的缘故。pH<5.6的雨水,称为酸雨。通过测定雨水的pH可以了解当地空气污染的状况。雨水的pH越小,酸性越强,说明空气污染越严重。
状元笔记
酸雨是指pH<5.6的雨水。引起酸雨的大气污染物主要是氮的氧化物(如NO2)、硫的氧化物(如SO2)等。以煤为主要燃料的地区由于煤中含有硫,燃烧后生成大量SO2,遇水生成H2SO3,再氧化成H2SO4,酸雨中以硫酸为主;以石油产品为主要燃料的地区,酸雨中以硝酸为主。
(4)体液的pH与人体健康的关系
健康人的体液pH有一个正常范围,如果体液pH超过正常范围,就会导致生理功能失调或发生疾病。例如胃酸分泌过多会使胃液的pH降到正常水平以下,容易出现胃痛等症状。测定人体或排出溶液的pH,可以知道人体的健康状况。
状元笔记
人的体液中酸性最强的是胃液,胃液的pH在0.9-1.5之间,胃酸的主要成分是盐酸。在这样的环境中铁屑都可以溶解,但胃本身却安然无恙!因为胃里有一层“黏液屏障”,起保护作用。
[示例]化学物质及其变化与生活密切相关。
(1)健康人的体液pH必须维持在一定范围内。如果体液pH超越正常范围,就会导致某些疾病的产生。胃液的pH_______7(填“大于”“小于”或“等于”) 。人体内二氧化碳排出不畅时,会导致血液pH___________(填“升高”或“降低”)。
(2)下表是一些作物适宜生长的pH范围:
|
作物 |
茶树 |
柑橘 |
西瓜 |
甘草 |
|
最适宜种植的土壤pH范围 |
5.0-5.5 |
5.0-7.0 |
6.0-7.0 |
7.2-8.5 |
江西素有“红土壤”之称,红土壤偏酸性。上述作物不适宜在红土壤中种植的是________。
解析:胃内含有盐酸,酸性溶液的pH<7;人体内二氧化碳排出不畅时,会溶解在血液中形成碳酸,使血液的酸性增强,pH降低;由表中数据可知甘草适宜生长的土壤pH为7.2-8.5,显弱碱性,故甘草不适宜种植在偏酸性的红土壤中。
我们知道,用酸碱指示剂可以测定溶液的酸碱性。在生活、生产和科研中,有时仅知道溶液的酸碱性是不够的,还需要确切知道溶液酸碱性强弱的程度--酸碱度。怎样表示溶液的酸碱度呢?化学上常用pH来表示溶液的酸碱度,其取值范围为0-14。
状元笔记
溶液的酸碱性不同于溶液的酸碱度。溶液的酸碱性是指溶液是酸性还是碱性,常用酸碱指示剂来检验溶液的酸碱性;而溶液的酸碱度是指溶液酸碱性强弱的程度。可用pH试纸来测定。
1.溶液的酸碱性与pH的关系(见下图)
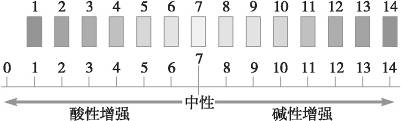
pH<7 溶液为酸性,pH越小,酸性越强
pH>7 溶液为碱性,pH越大,碱性越强
pH=7 溶液为中性,如纯水显中性
测定溶液pH最简便的方法是用pH试纸。pH试纸的使用方法:
用胶头滴管(或玻璃棒)把待测液滴在pH试纸上,然后把pH试纸显示的颜色与标准比色卡对照,与标准比色卡上颜色相近的pH即为该溶液的pH。
说明:(1)使用pH试纸时,直接将待测液涂在试纸上,不能先用水将试纸湿润,否则使测量结果不准确。
(2)不能将试纸直接放入待测液中,这样会污染待测液。
(3)试验使用的pH试纸一般是广范pH试纸,测出的pH是1-14的整数,结果较粗略,要准确测量,可用精密pH试纸或pH计。
状元笔记
pH通常用来表示溶质的质量分数较小的水溶液的酸碱性,对于溶质的质量分数较大的溶液,一般直接用H+浓度或OH-浓度表示,不再用pH来表示。故pH=0的溶液不是酸性最强的,pH=14的溶液也不是碱性最强的。
[示例](2008南通)在生活、生产和科学研究中,常用pH试纸测定溶液的pH。以下测定操作正确是( )
A.将被测液滴到放在玻璃片上的pH试纸上,显色后,与标准比色卡比较
B.将pH试纸直接投入被测液中,显色后,取出与标准比色卡比较
C.先用少量水湿润试纸,后滴上被测液,显色后,与标准比色卡比较
D.先用蒸馏水清洗滴管,随后吸取被测液滴到试纸上,显色后,与标准比色卡比较
解析:A是测定溶液pH的正确方法;B操作会将待测液污染;C、D操作会将溶液稀释,影响溶液的pH。
答案:A
活动与探究 测定生活中常见溶液的pH
方法:在白瓷板或玻璃片上放一小片pH试纸,将待测液滴到pH试纸上,然后跟标准比色卡对照,读出pH。
生活中一些常见物质的溶液的pH如下表。
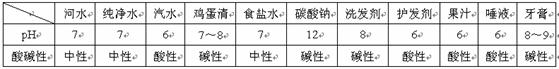
[示例]下图所示是生活中一些常见物质的pH,参照图示判断,下列说法正确的是( )

A.酱油呈碱性
B.葡萄汁能使无色酚酞溶液变红
C.胃酸过多的人可多喝玉米粥
D.西瓜汁的酸性要比苹果汁的酸性强
解析:根据图示物质的pH:酱油pH为5,应显酸性,故A不正确;葡萄汁的pH为4,显酸性,不能使无色酚酞溶液变红,故B不正确;玉米粥pH为8,显碱性,而人体内胃酸显酸性,胃酸过多的人多喝玉米粥,可消除过多的胃酸,故C正确;西瓜汁pH为6,苹果汁pH为3,pH越小,酸性越强,因此西瓜汁的酸性不比苹果汁的酸性强。
答案:C
3.用于医药卫生
人的胃液因含有盐酸而呈酸性,当胃液的pH为0.9-1.5时,有助于食物消化。如果胃酸过多,超出正常pH范围,会很痛苦,需服用碱性药物如Mg(OH)2、Al(OH)3等,使碱与胃酸发生中和反应,生成无毒中性物质,从而调节胃酸的pH达到正常范围。反应方程式:
Mg(OH)2+2HCl====MgCl2+2H2O Al(OH)3+3HCl====AlCl3+3H2O。
另外,当我们被蚊虫叮咬后,由于这类昆虫的分泌物是一种酸性物质,会使我们感到又痛又痒。这时你可以涂上稀氨水、肥皂水或牙膏等物质来消痛止痒,因为这类物质是碱性的,可中和昆虫分泌的酸。
状元笔记
治理胃酸过多不能用熟石灰或烧碱,因为这两种物质腐蚀性强。一般用无腐蚀性的碱如氢氧化镁、氢氧化铝或碳酸氢钠等。涂抹皮肤时也要注意不要用腐蚀性太强的氢氧化钠溶液。
[示例]食用松花蛋时常感到有涩味,这是因为制作松花蛋的过程中用到了熟石灰和纯碱等原料。为了减轻涩味,可在食用松花蛋时添加某种调味品,这种调味品最好是( )
A.食盐 B.食醋 C.香油 D.味精
解析:由题中给出的信息“在制作松花蛋的过程中用到了熟石灰和纯碱”,熟石灰是碱,纯碱溶液显碱性,两者反应Na2CO3+Ca(OH)2====CaCO3↓+2NaOH,有NaOH生成,这些碱性物质使松花蛋有涩味。根据酸与碱中和反应的原理,所选调味品应呈酸性,故选B。
答案:B
2.处理工厂的废水
工厂的废水常显酸性或碱性,若直接排放会造成水污染,所以需进行处理后才能排放。碱性污水需用酸来中和,酸性污水需用碱来中和。如硫酸厂的污水中常含有硫酸等酸性物质,可以用熟石灰进行改良。
反应方程式为
Ca(OH)2+H2SO4====CaSO4+2H2O。
中和反应在日常生活和工农业生产中有很重要的应用。
1.改变土壤的酸碱性
在土壤里,由于有机物分解产生的有机酸、土壤风化产生的酸性物质以及空气污染造成的酸雨等,都可以使土壤呈酸性,从而不利于作物的生长。这时,在土壤中使用适量的碱,如熟石灰,可以中和土壤中的酸,从而利于作物的生长。
状元笔记
改良酸性土壤一般用氢氧化钙而不用氢氧化钠,因为氢氧化钠的腐蚀性太强。
[实验10-9] 盐酸与氢氧化钠的反应
在烧杯中加入10 mL氢氧化钠溶液,滴入几滴酚酞溶液,再用滴管慢慢滴入稀盐酸,并不断搅拌,至溶液颜色恰好变成无色为止。(见下图)
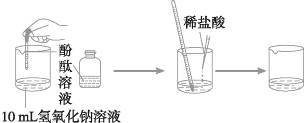
现象:溶液逐渐由红色变为无色。
解释:产生以上现象是因为盐酸与氢氧化钠发生了化学反应:
HCl+NaOH====NaCl+H2O
因为盐酸和氢氧化钠反应后生成氯化钠,没有明显现象,所以该反应要借助指示剂来观察反应进行的程度。这是因为酚酞遇到碱溶液时显红色,遇到酸或中性溶液时显无色。通过酚酞颜色的变化,证明盐酸与氢氧化钠溶液确实发生了反应,生成了中性的盐。
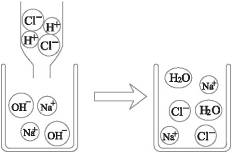
该反应的微观解释如下图所示:
除了盐酸和氢氧化钠能发生反应外,其余的酸和碱也都能发生类似的反应,如:
2HCl+Ca(OH)2====CaCl2 +2H2O
氯化钙
H2SO4+2NaOH====Na2SO4+2H2O
硫酸钠
以上三个反应的生成物:NaCl 、CaCl2 、Na2SO4三种物质都是由金属离子和酸根离子构成的,这样的化合物叫做盐。
状元笔记
盐酸与氢氧化钠反应时,加入酚酞溶液的作用是帮助判断反应是否发生以及何时进行完毕。当红色刚刚消失时,反应恰好完成。
盐在水溶液中能解离出金属离子和酸根离子。生活中常见的盐还有CuSO4、KCl、CaCO3、Na2CO3、KMnO4等。
以上反应的共同点是:反应物是酸和碱,生成物是盐和水。
像这样:酸与碱作用生成盐和水的反应叫做中和反应。
从上图可以看出,中和反应的实质是酸中的H+与碱中的OH-反应生成水,即H++OH-====H2O。
溶液中的溶质是酸中酸根离子与碱中的金属离子结合生成的盐。
状元笔记
生成盐和水的反应不一定是中和反应,如CuO+H2SO4====CuSO4+H2O就不是中和反应。中和反应的反应物必须是酸和碱。
[示例]下列反应属于中和反应的是( )
A.CO2+2NaOH====Na2CO3+H2O
B.CuO+H2SO4====CuSO4+H2O
C.KOH+HNO3====KNO3+H2O
D.Fe+2HCl====FeCl2+H2↑
解析:中和反应是酸和碱作用生成盐和水的反应,反应物一定是酸和碱,生成物一定是盐和水。对以上四个选项进行分析可知,只有C项符合题意。
答案:C
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com