
题目列表(包括答案和解析)
24.(3分)(1) (2) (3)
23.(8分)(1) , ,(各1分)
(2) ,
(各2分)
30.(8分)现有含0.04mol的AlCl3和0.06mol的FeCl3的混合溶液110mL,向其中加入4mol/L的NaOH溶液90mL,使其充分反应(假设反应后溶液的体积为两者体积之和)。 (1)所得沉淀物质的量为多少?
(2)溶液中除Na+,Cl-外其它离子物质的量浓度各为多少?
福建省长泰一中09-10学年高二上学期期末考试 化学(理科)答题卷
可能用到的相对原子量:Zn:65 Fe:56 Al:27 O:16 Cl:35.5
Na:23 H:1 C:12
29.(6分)汽车是现代社会重要的交通工具,它造福于人类,但同时对自然生态环境的恶化有难以推卸的责任。(1)设汽油的成分是辛烷,相同的条件下辛烷气与空气的体积比为V,要使辛烷恰好完全燃烧,V的最大值Vmax是多少?(空气中的氧气的体积分数按20﹪计算)
(2)若辛烷气与空气的体积比小于(1)中的Vmax,则汽车尾气中相对增多的有害气体是 。
(3)CO与NO是汽车尾气中的有害气体,它们在催化转化器中能反应生成完全无毒的物质,试写出它们反应的化学方程式
28.(8分)根据下面的反应路线及所给的信息填空

(1)A的结构简式是 名称是
(2)①的反应类型是 ③的反应类型是
(3)反应②的化学方程式
(4)反应④的化学方程式
27.(10分)在足量的稀氯化亚铁溶液中,加入1-2滴液溴,振荡后溶液变为黄色。
(3)甲同学认为这不是发生化学反应所致,使溶液变黄色的物质是:
(填粒子的化学式,下同);乙同学认为这是发生化学反应所致,使溶液变黄色的物质是
(4)现提供以下试剂:A.酸性高锰酸钾溶液 B.氢氧化钠溶液 C.四氯化碳
D.硫氰化钾溶液.请判断哪位同学的推断是正确的,并用两种方法加以验证,写出选用的试剂编号及实验中观察到的现象。
|
同学正确 |
选用试剂 |
实验现象 |
|
第一种方法 |
|
|
|
第二种方法 |
|
|
(1) 根据上述实验推测,若在稀溴化亚铁溶液中通入氯气,首先被氧化的离子是 若选用淀粉碘化钾溶液来判断哪位同学的推断是正确的,你认为是否可行? 理由是:
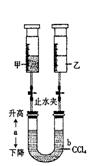
26.(6分)在常温常压下,注射器甲中装有N02气体,注射器乙中装有
相同体积的空气(如图所示,夹持仪器均已略去)
(1)常温下,打开两个止水夹后,同时向外拉动两注射器的活塞,且拉动的距离相同,将会看到U形管中液面a. (填升高、下降 或不变)。试解释这一现象:
(2)如将注射器甲中的气体换成NH3、U形管中的CCl4换成水,仍在常温下,打开两个
止水夹后,同时向里推动两注射器的活塞,且推动的距离相同,将会看到U形管中液面a (填升高 、 下降 或 不变 )。试解释这一现象
25.(7分)某二元酸(化学式用H2B表示)在水中的电离方程式是:
H2B H+ + HB– HB– H+ + B2–
回答下列问题:
H+ + B2–
回答下列问题:
(1)Na2B溶液显______(填“酸性”,“中性”,或“碱性”)。理由是____(用离子方程式表示)。
 (2)在0.1 mol/L的Na2B溶液中,下列粒子浓度关系式正确的是________。
(2)在0.1 mol/L的Na2B溶液中,下列粒子浓度关系式正确的是________。
A.c (B2– ) + c (HB– ) + c (H2B) = 0.1 mol/L
B.c (Na+ ) + c (OH– ) = c (H+) + c (HB– )
C.c (Na+ ) + c (H+ ) = c (OH – ) + c (HB– ) + 2c (B2 – )
D.c (Na+ ) = 2c (B 2– ) + 2c (HB– )
(3)0.1 mol/L NaHB溶液中各种离子浓度由大到小的顺序是______________
24、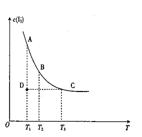 (3分)实验室中配制碘水,往往是将I2溶于 KI溶液中,这样就可以得到浓度较大的碘水,主要是因为发生了反应:I2(aq)+I-
(3分)实验室中配制碘水,往往是将I2溶于 KI溶液中,这样就可以得到浓度较大的碘水,主要是因为发生了反应:I2(aq)+I-
 I3- 上述平衡体系中,I3-的物质的量浓度c(I3-) 与温度T的关系如右图所示(曲线上的任何一点都表示平衡状态)。(1)通过分析上图,该反应的正反应为 反应(填 吸热 或 放热 ),
I3- 上述平衡体系中,I3-的物质的量浓度c(I3-) 与温度T的关系如右图所示(曲线上的任何一点都表示平衡状态)。(1)通过分析上图,该反应的正反应为 反应(填 吸热 或 放热 ),
(2)A状态与C状态的化学反应速率比较为υ (A) υ(C)(填 > 、 < 或 =)。
(3)在T1、D状态时,υ正 υ逆 (填 > 、 < 或 = )。
23.(8分)某固体是由Na2CO3、NaOH、MgCl2、AlCl3、BaCl2、Fe2(SO4)3、(NH4)2SO4中的两种混合而成。取该固体溶于水得到无色澄清溶液,向该溶液中加入稀硫酸,有白色沉淀生成,继续加入稀硫酸,沉淀又完全消失,且整个过程无气体产生。则:
⑴原固体中含有 和 ;
⑵写出整个过程中有关反应的离子方程式: 、
、
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com