
题目列表(包括答案和解析)
29.(11分)II、I、下图中每一方框中的字母代表一种反应物或生成物;产物J是含金属元素A的白色胶状沉淀,B为非金属气体单质,C为活泼金属单质,D是淡黄色固体单质,I为NaCl溶液。
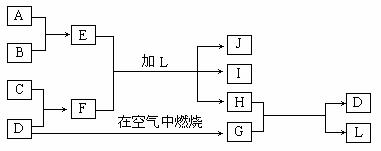
试填写下列空白:
(1)写出元素A的原子结构示意图___________________________
(2)写出图中H的电子式________________________________。
(3)写出反应E+F+L → J+I+H的离子方程式______________________________________。
(4)H和G之间反应的化学方程式为______________________________________________。
III、炸油条时常用明矾和纯碱作膨化剂,因为两者发生反应,并在受热时生成___________气体,有关的离子方程式______________________________________________________________。
28.(6分)T℃时,有甲、乙两个密闭容器,甲容器的体积为1L,乙容器的体积为2L,分别向甲、乙两容器中加入6mol A和3mol B,发生反应如下:3A(g)+b B(g)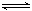 3C(g)+2D(g),
3C(g)+2D(g), ;4min后甲容器内的反应达到平衡,A的浓度为2.4mol/L,B的浓度为1.8mol/L;t min后乙容器内的反应达到平衡,B的浓度为0.8mol/L。根据题给的信息回答下列问题:
;4min后甲容器内的反应达到平衡,A的浓度为2.4mol/L,B的浓度为1.8mol/L;t min后乙容器内的反应达到平衡,B的浓度为0.8mol/L。根据题给的信息回答下列问题:
(1)甲容器中反应的平均速率 (B)=_______________,化学方程式中计量数b=________。
(B)=_______________,化学方程式中计量数b=________。
(2)乙容器中反应达到平衡所需时间t_______4min(填“大于”、“小于”或“等于”),
原因是___________________________________________________________。
(3)T℃时,在另一个体积与乙相同的丙容器中,向丙容器中加入C、D的物质的量分别为3mol、2mol,为了达到平衡时B的浓度仍然为0.8mol/L,则还需加入A、B的物质的量分别是_________________、_____________________。
26.(8分)在常温下,下列五种溶液:
①0.1mol/LNH4Cl ②0.1mol/LCH3COONH4 ③0.1mol/LNH4HSO4 ④0.1mol/LNH3·H2O和0.1mol/LNH4Cl混合液 ⑤0.1mol/LNH3·H2O
请根据要求填写下列空白:
(1)在上述五种溶液中, PH最小的是_____________;C(NH4+)最小的是________(填序号)
(2)比较溶液②、③中C(NH4+)的大小关系是②_______________③(填“>”、“<”或“=”)
(3)在溶液④中,_____________离子的浓度为0.1mol/L;NH3·H2O和_____________离子的物质的量浓度之和为0.2mol/L。
(4)常温下,测得溶液②的PH=7,则说明CH3COO- 的水解程度__________(填“>”、“<”或“=”)NH4+的水解程度,CH3COO- 与NH4+ 浓度的大小关系是:C(CH3COO-)_________ C(NH4+)(填“>”、“<”或“=”)
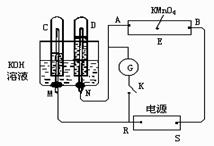 27.(8分)如图所示,E为沾有Na2SO4溶液的滤纸,并加入几滴酚酞。A,B分别为Pt片,压在滤纸两端,R、S为电池的电极。M、N是用多微孔的Ni的电极材料,它在碱溶液中可以视为惰性电极。G为电流计,K为开关。C、D和电解池中都充满浓KOH溶液。若在滤纸中央点上一滴紫色的KMnO4溶液,K打开,接通电源一段时间后,C、D中有气体产生,气体体积如图所示。
27.(8分)如图所示,E为沾有Na2SO4溶液的滤纸,并加入几滴酚酞。A,B分别为Pt片,压在滤纸两端,R、S为电池的电极。M、N是用多微孔的Ni的电极材料,它在碱溶液中可以视为惰性电极。G为电流计,K为开关。C、D和电解池中都充满浓KOH溶液。若在滤纸中央点上一滴紫色的KMnO4溶液,K打开,接通电源一段时间后,C、D中有气体产生,气体体积如图所示。
(1)外电源的S为__________极。
(2)A附近溶液的现象是______________________________, B附近发生的电极反应式为____________________________
(3)滤纸上的紫色点向哪方移动__________(填A或B)。
(4)当C、D里的气体产生到一定量时,切断外电源并接通开关K,经过一段时间,C、D中气体逐渐减少,主要因为_______________________________________________________________,
写出C处的电极反应式
______________________________________________________________。
25.(9分)在25℃时,对于0.1mol·L-1的氨水,请回答以下问题:
(1)若向氨水中加入少量硫酸铵固体,此时溶液中将__________(填“增大”、“减小”或“不变”);
(2)若向氨水中加入pH=1的硫酸,且氨水与硫酸的体积比为1∶1,此时溶液的pH _______7(填“大于”、“小于”或“等于”),用离子方程式表示其原因__________________________,
此时溶液中各离子浓度由大到小的顺序为
___________________________________________;
(3)若向氨水中加入0.05mol·L-1稀硫酸至溶液正好呈中性,所用氨水的体积V1与稀硫酸的体积V2的关系为V1_______V2(填“大于”、“小于”或“等于”),写出溶液中各离子浓度之间满足的电荷守恒表达式
_______________________________________________________。
|
1 |
2 |
3 |
4 |
5 |
6 |
7 |
8 |
9 |
10 |
11 |
12 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
13 |
14 |
15 |
16 |
17 |
18 |
19 |
20 |
21 |
22 |
23 |
24 |
|
|
|
|
|
|
|
|
|
|
|
|
|
24. 为确定某溶液的离子组成,进行如下实验:
①测定溶液的pH,溶液显强碱性
②取少量溶液加入稀盐酸至溶液呈酸性,产生无刺激性气味、能使澄清石灰水变浑浊的气体
③在②实验后的溶液中再滴加Ba(NO3)2溶液,产生白色沉淀
④取③实验后的上层清液继续滴加Ba(NO3)2溶液至无沉淀时,再滴加AgNO3溶液,产生白色沉淀
根据实验判断,以下推测正确的是
A. 一定有SO32-离子 B. 一定有HCO3-离子
C. 不能确定CO32-离子是否存在 D. 不能确定Cl-离子是否存在
淮北一中2009-2010学年度第一学期高二期末考试
化学反应原理
23.下列说法正确的是
A.90℃时,纯水的pH等于7
B.已知一种c (H+)=1×10-3mol/L的酸和一种c (OH-)=1×10-3mol/L碱溶液以等体积混合后,溶液呈酸性,其原因是浓的弱酸和稀碱反应所致
C.配制FeCl3溶液,为了抑制水解,常加稀硫酸
D.在Na2S溶液中,离子浓度的关系是:C(Na+)>C(S2-)>C(HS-)>C(OH-)>C(H+)
22.下列事实,不能用平衡移动原理解释的是
A. 硫酸工业中,增大O2的浓度有利于提高SO2的转化率
B. 将FeS固体投入到含有Cu2+的废水中以除去Cu2+
C. 选择合适的催化剂可使水在较低温度下分解
D. 滴有酚酞的CH3COONa溶液,加热后颜色变深
21.下列各种溶液中,可能大量共存的离子组是
A. pH=0的溶液中:Fe2+、NO3-、SO42-、I-
B. 由水电离出的c(OH-)=1×10-13mol·L-1的溶液中:Na+、[Al(OH)4]-、S2-、CO32-
C. 含有大量Fe3+的溶液中:Na+、I-、K+、NO3-
D. c(H+)=10-14mol·L-1的溶液中:Mg2+、NO3-、Fe2+、ClO-
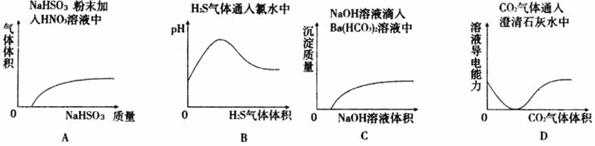
20.下列实验过程中产生的现象与对应的图形相符合的是
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com