
题目列表(包括答案和解析)
6.有机物分子中的原子(团)之间会相互影响,导致相同的原子(团)表现不同的性质。下列各项的事实不能说明上述观点的是( )
A.甲苯能使酸性高锰酸钾溶液褪色,而苯不能使酸性高锰酸钾溶液褪色
B.乙烯能与溴水发生加成反应,而乙烷不能发生加成反应
C.苯酚与溴水可直接反应,而苯与液溴反应则需要催化剂
D.苯酚可以与NaOH溶液反应,而乙醇通常不能与NaOH溶液反应
5.在乙酸乙酯、乙醇、乙酸水溶液共存的化学平衡体系中加入重水(D2O),经过足够长的时间后,可以发现,除水外体系中含重氢(D)的化合物是( )
A.只有乙醇 B.只有乙酸 C.只有乙酸乙酯、乙醇 D.乙醇、乙酸
4.有机物A的结构简式如右所示,则A可能发生的反应类型有( )
①取代 ②加成 ③消去 ④水解 ⑤酯化 ⑥中和 ⑦氧化 ⑧加聚
A.①②③④⑥ B.②③④⑤⑧ C.③④⑤⑥⑦ D.①②③⑤⑥⑦
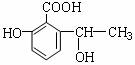
3.下列除去杂质或鉴别物质的方法中,不正确的是( )
A. 苯和甲苯:可用浓溴水鉴别
B. 乙酸乙酯混有少量乙酸:用饱和碳酸钠溶液洗涤后分液
C. 苯中混有少量苯酚:加入氢氧化钠溶液后分液
 D.
乙醇中混有少量水:加入CaO,然后蒸馏
D.
乙醇中混有少量水:加入CaO,然后蒸馏
2.下列物质在一定条件下能被氧化生成醛的是( )

1.降解塑料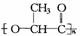 在乳酸菌作用下迅速分解为无毒物质.下列有关降解塑料叙述不正确的是( )
在乳酸菌作用下迅速分解为无毒物质.下列有关降解塑料叙述不正确的是( )
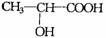 A.降解塑料是一种高分子化合物
B.其分子量为72n
A.降解塑料是一种高分子化合物
B.其分子量为72n
C.经加成聚合反应生成 D.其单体是
27.(9分)某化学实验小组想要了解市场上所售食用白醋(主要是醋酸的水溶液)的准确浓度,现从市场上买来一瓶某品牌食用白醋,用实验室标准NaOH溶液对其进行滴定,完全反应时所得溶液pH大致为9 。下表是4种常见指示剂的变色范围:
|
指示剂 |
石蕊 |
甲基橙 |
甲基红 |
酚酞 |
|
变色范围(pH) |
5.0-8.0 |
3.1-4.4 |
4.4-6.2 |
8.2-10.0 |
 (1)该实验应选用
作指示剂,向锥形瓶中移取一定体积的白醋所用的滴定管是
。( 酸式滴定管 或 碱式滴定管 )
(1)该实验应选用
作指示剂,向锥形瓶中移取一定体积的白醋所用的滴定管是
。( 酸式滴定管 或 碱式滴定管 )
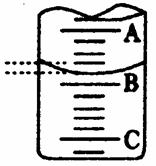
(2)右图表示50mL滴定管中液面的位置,若A与C刻度间相差1mL,A处的刻度为25,滴定管中液面读数应为 mL,设此时液体体积读数为 a ml ,滴定管中液体的体积 V (=、>、<) ( 50-a ) ml
(3)为了减小实验误差,该同学一共进行了三次实验,假设每次所取白醋体积均为VmL,NaOH标准液浓度为c mo1/L,三次实验结果记录如下:
|
实验次数 |
第一次 |
第二次 |
第三次 |
|
消耗NaOH溶液体积/mL |
26.02 |
25.35 |
25.30 |
从上表可以看出,第一次实验中记录消耗NaOH溶液的体积明显多于后两次,其原因可能是
A.实验结束时俯视刻度线读取滴定终点时NaOH溶液的体积
B.滴定前滴定管尖嘴有气泡,滴定结束无气泡
C.盛装标准液的滴定管装液前用蒸馏水润洗过,未用标准液润洗
D.滴加NaOH溶液过快,未充分振荡,刚看到溶液变色,立刻停止滴定
(4)根据所给数据,写出计算该白醋中醋酸的物质的量浓度的表达式(不必化简):
C= mol/L。
26.(13分)25℃时,将0.01 mol CH3COONa 和0.002 mol HCl溶于水,形成1L混合溶液:
(1)该溶液中存在三个平衡体系,用电离方程式或水解离子方程式表示:
①
②
③ 。
(3)溶液中粒子,有
、 、 阴离子, 、 阳离子和 、
分子
(3)在这些粒子中,浓度为0.01 mol/L的是 ,浓度为0.002 mol/L的是 。
(4) 和 两种粒子物质的量之和等于0.01 mol。
25.(8分)在一定体积的密闭容器中,进行如下化学反应:
CO2(g)+H2(g)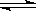 CO(g)+H2O(g)
CO(g)+H2O(g)
其化学平衡常数K和温度t的关系如下表:
|
t℃ |
700 |
800 |
830 |
1000 |
1200 |
|
K |
0.6 |
0.9 |
1.0 |
1.7 |
2.6 |
回答下列问题:
(1)该反应正向为ΔH 0;若该正向反应在某一温度压强下不自发进行,推测其熵变ΔS 0(选填“<”或“>”)
(2)能判断该反应达到化学平衡状态的依据是 。
(a)容器中压强不变 (b)混合气体中c(CO)不变
(c)v正(H2)=v逆(H2O) (d)c(CO2)=c(CO)
(3)某温度下,平衡浓度符合下式: 0.9·c(CO2)·c(H2)=c(CO)·c(H2O),试判断此时的温度为 ℃。其它条件不变,升高温度,原化学平衡向 反应方向移动(填“正”或“逆”)。
(4)若在一密闭容器中,将一定量的CO与H2O混合加热到830℃下达到平衡。若反应开始时CO与H2O的浓度分别为0.200 mol·L–1和0.100 mol·L–1,平衡时CO的转化率 。
24.(8分) 在常温下,下列五种溶液:
①0.1mol/L NH4Cl ②0.1mol/L CH3COONH4 ③ 0.1mol/L NH4HSO4
④0.1mol/L NH3·H2O和0.1mol/L NH4Cl混合液 ⑤0.1mol/L NH3·H2O
请根据要求填写下列空白:
(1)溶液①呈 性(填“酸”、“碱”或“中”),其原因是(用离子方程式表示)
(2)在上述五种溶液中,pH最小的是 ;c(NH4+) 最大的是 ﹝填序号﹞
(3)比较溶液①、③中c(NH4+)的大小关系是① ③ ﹝填“>”、“<”或“=”)
(4)常温下,测得溶液②的pH=7,则说明CH3COO-的水解程度________(填“>”、“<”或“=”) NH4+ 的水解程度,CH3COO-与NH4+浓度的大小关系是:
c(CH3COO-) c(NH4+)(填“>”、“<”或“=”)
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com