
题目列表(包括答案和解析)
3.下列化学反应的离子方程式正确的是
A.在稀氨水中通入过量CO2:NH3·H2O+CO2=NH4++HCO3-
B.少量SO2通入Ca(ClO)2溶液中:SO2+H2O+Ca2++2ClO-=CaSO3↓+2HClO
C.用稀HNO3溶液FeS固体:FeS+2H+=Fe2++H2S↑
D.氢氧化钙溶液与等物质的量的稀硫酸混合:Ca2++OH-+H++SO42-=CaSO4↓+H2O
2. 向含
向含 的溶液中逐滴加入含一定量HCl的稀盐酸,经充分反应后,溶液中各溶质的物质的量判断可能正确的是
的溶液中逐滴加入含一定量HCl的稀盐酸,经充分反应后,溶液中各溶质的物质的量判断可能正确的是
A.得 和
和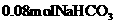
B.剩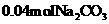 得
得
C.剩 ,得
,得 和
和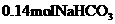
D.得 和
和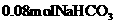
1.有一无色未知溶液中检验出有Ba2+、Ag+,同时又测得其酸性很强。某学生还要鉴
定此溶液中是否大量存在
①Cu2+ ②Fe3+ ③CI- ④NO3- ⑤S2-
⑥CO32- ⑦NH4+ ⑧Mg2+ ⑨AI3+ ⑩AIO2-
其实,这些离子中有一部分不必再鉴定就能加以否定,你认为不必鉴定的离子组是
A.①②③⑤⑥⑩ B.①②⑤⑥⑧⑨
C.③④⑦⑧⑨ D.③⑤⑥⑦⑩
26.(8分)现有AlCl3和FeCl3混合溶液,其中Al3+和Fe3+的物质的量之和为0.1mol,在此溶液中加入90mL4mol/L的NaOH溶液,使其充分反应.设Al3+物质的量与总物质的量的比值为x.
(1)根据反应的化学方程式计算x=0.4时,溶液中产生的沉淀是什么?物质的量有多少?
(2)计算沉淀中只有Fe(OH)3的x取值范围。
请在图中画出沉淀总量(摩)随x(0→1)变化的曲线.
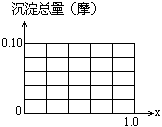
(3)若Al3+和Fe3+物质的量之和为A摩(A为合理数值),其他条件不变时,求沉淀中同时有Fe(OH)3、Al(OH)3的x取值范围(用含有A、x的式子表示).
25.(6分) 有A、B两种烃,它们的组成相同,都含90%的碳,烃A对氢气的相对密度是20;
 烃B式量是烃A的3倍,烃A在一定条件下能与足量的Cl2起加成反应,生成1,1,2,2-四氯丙烷,烃B是苯的同系物,当它与Cl2发生取代反应时(取代苯环上的H原子),生成的一氯代物、二氯代物、三氯代物分别都只有一种,根据以上实验事实,推断A、B两烃的分子式、结构简式。
烃B式量是烃A的3倍,烃A在一定条件下能与足量的Cl2起加成反应,生成1,1,2,2-四氯丙烷,烃B是苯的同系物,当它与Cl2发生取代反应时(取代苯环上的H原子),生成的一氯代物、二氯代物、三氯代物分别都只有一种,根据以上实验事实,推断A、B两烃的分子式、结构简式。
24.(8分)有人设想合成具有以下结构的烃分子。
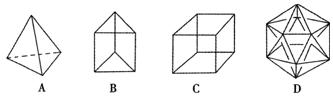
(1)结构D显然是不可能合成的,原因是 。
(2)在结构A的每两个碳原子之间插入一个CH2原子团,可以形成金刚烷的结构,写
出金刚烷的分子式 。
(3)B的一种同分异构体是最简单的芳香烃,能证明该芳香烃中的化学键不是单双键交
替排列的事实是 。
a.它的对位二元取代物只有一种 b.它的邻位二元取代物只有一种
c.分子中所有碳碳键的键长均相等 d.能发生取代反应和加成反应
(4)C的一种属于芳香烃的同分异构体是生产某塑料的单体,写出合成该塑料的化学方程式 。
23. (10分)以富含硫酸亚铁的工业废液为原料生产氧化铁的工艺如下(部分操作和条件略):
Ⅰ.从废液中提纯并结晶出FeSO4·7H2O。
Ⅱ.将FeSO4·7H2O配制成溶液。
Ⅲ. 溶液与稍过量的
溶液与稍过量的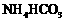 溶液混合,得到含
溶液混合,得到含 的浊液,同时有CO2气体放出。
的浊液,同时有CO2气体放出。
 Ⅳ.将浊液过滤,用90℃热水洗涤沉淀,干燥后得到
Ⅳ.将浊液过滤,用90℃热水洗涤沉淀,干燥后得到 固体。
固体。
Ⅴ.煅烧 ,得到
,得到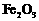 固体。
固体。
已知: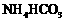 在热水中分解。
在热水中分解。
(1)Ⅰ中,加足量的铁屑除去废液中的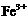 ,该反应的离子方程式是
。
,该反应的离子方程式是
。
(2)Ⅱ中,需加一定量硫酸。运用化学平衡原理简述硫酸的作用
(3)Ⅲ中,生成 的离子方程式是 。
的离子方程式是 。
若 浊液长时间暴露在空气中,会有部分固体表面变为红褐色,该变化的化学方
浊液长时间暴露在空气中,会有部分固体表面变为红褐色,该变化的化学方
式是 。
(4)已知锻炼 的化学方程式是
的化学方程式是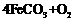

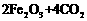 。现锻炼464.0kg
。现锻炼464.0kg
的 ,得到316.8kg产品。若产品中杂质只有
,得到316.8kg产品。若产品中杂质只有 ,则该产品中
,则该产品中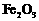 的质量是
的质量是
kg.
22. I.(2分)亚硝酸钠(NaNO2)又称工业盐,其外观类似食盐,但有剧毒。近年来,建筑
工地多次发生民工误食工业盐而中毒的事件。利用如下反应可鉴别NaNO2和NaCl。
___KMnO4+ ___NaNO2+ ___H2SO4==== ___MnSO4+ ___K2SO4+ ___NaNO3+ ___H2O配平上述反应的化学方程式;
II.(4分)NaHA和NaHB两种酸式盐的溶液分别加水稀释时,pH值的变化如下图所示。
 (1)H2A是___________酸(填“强”或“弱”)。
(1)H2A是___________酸(填“强”或“弱”)。
 (2)常温时,0.1
mol/L的NaHB溶液与0.1
mol/L NaOH溶液等体积混合后溶液的pH_________7,原因是(用离子方程式表示)
(2)常温时,0.1
mol/L的NaHB溶液与0.1
mol/L NaOH溶液等体积混合后溶液的pH_________7,原因是(用离子方程式表示)
____________________________________________________
III. (4分)肼(N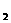 H
H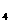 )又称联氨,是一种可燃性的液体,可用作火
)又称联氨,是一种可燃性的液体,可用作火
箭燃料。又知NH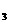 与N
与N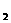 H
H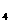 、NH
、NH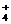 与N2H
与N2H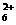 的性质具有某些相似性。
的性质具有某些相似性。
(1)写出N2H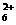 与足量NaOH溶液反应的离子方程式_______________________________。
与足量NaOH溶液反应的离子方程式_______________________________。
(2)肼一空气燃料电池是一种碱性燃料电池,电解质溶液是20%-30%的KoH溶液。
肼一空气燃料电池放电时正极的电极反应式:__________________________________。
21. (8分)W、X、Y、Z是原子序数依次增大的同一短周期元素,W是金属元素,X是地壳中
含量最多的金属元素,且W、X的最高价氧化物的水化物相互反应生成盐和水;Y、Z是非金属元素,Y与W可形成离子化合物W2Y;G在Y的前一周期,其原子最外层比Y原子最外层少一个电子。
(1)X的原子结构示意图为 ;
(2)W、X的最高价氧化物的水化物相互反应的离子方程式为 ;
(3)工业上制取X单质的化学方程式为 ;
(4)G的气态氢化物与Y的最高价氧化物的水化物恰好反应生成的正盐溶液中,离子浓度由大到小的顺序为 。
20. 在一个容积固定的密闭容器中,加入m molA、n mol B,发生反应mA(气)+nB(气)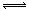 pC
pC
 (气),平衡时C的浓度为w
mol/L.若容器体积和温度不变,起始时放入a mol A,b mol B,c mol C,要使平衡后C的浓度仍为w mol/L,则a、b、c必须满足的关系是
(气),平衡时C的浓度为w
mol/L.若容器体积和温度不变,起始时放入a mol A,b mol B,c mol C,要使平衡后C的浓度仍为w mol/L,则a、b、c必须满足的关系是
①a∶b∶c=m∶n∶p ②a∶b=m∶n,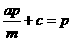
③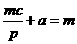 ,
,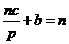 ④
④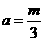 ,
,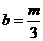 ,
,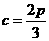
A.①② B.②③ C.③④ D.①④
湖北省沙市中学2009-2010学年上学期期末考试试卷
高二化学
命题人:付四喜 审题人:李德植
第II卷(非选择题 共50分)
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com