
题目列表(包括答案和解析)
19.(12分)(1)试写出CH3OH(l )在氧气中完全燃烧生成CO2和H2O(g)的热化学方程式:
(2)甲醇在 极反应;电极反应式为
(3)下列说法中正确的是 (填序号)。
22.(8分)电解原理在化学工业中有广泛应用。下图表示一个电解池,装有电解液a;X、Y是两块电极板,通过导线与直流电源相连。请回答以下问题:
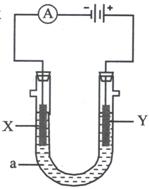
(1)若X、Y都是惰性电极,电解液a是饱和NaCl溶液,实验开始时,同时在两边各滴入几滴酚酞试液,则:
①电解池中X极上的电极反应式为 ;
在X极附近观察到的现象是 。
②Y电极上的电极反应式为 ,检验该电极反应产物的方法是 。
(2)如要用电解方法精炼粗铜,电解液a选用CuSO4溶液,则:
①X电极的材料是 ,电极反应式是 。②Y电极的材料是 ,电极反应式是 。
(说明:杂质发生的电极反应不必写出)。
第II卷(共46分)
21.(14分)已知25℃时,NaOH溶液和NaCN溶液的pH均为11。则:
(1)两溶液中c(H+)·c(OH-)= (填数值)。
(2)两溶液中由水电离出的c(OH-)分别是:a. NaOH b.NaCN .
(3)各取5mL上述两种溶液,分别加热到99℃时,pH较大的是 溶液。
(4)各取5mL上述两种溶液,分别加入水稀释至50 mL,pH较大的是 溶液。
(5)取5mL NaCN溶液,加水稀释至50mL,c(OH-) 10-4mol·L-1(填“<”、“=”或“>”),c(CN-)/c(OH-) (填“增大”、“减小”或“不变”).
20.(12分)实验室里配制了0.1mol·L-1的盐酸和0.1 mol·L-1的氨水两种溶液。试回答下列问题:
(1)在25℃时,0.1 mol·L-1的盐酸中的C(OH-)= 。
(2)在25℃时,已知氨水的电离平衡常数为Kb=1.7×10-5mol·L-1,1.3×1.3=1.7, 则当0.1mol·L-1的氨水在该温度下达到电离平衡时,溶液中的C (OH-) = ;写出一水合氨的电离方程式: 。
(3)在25℃时,将0.1 mol·L-1的盐酸和0.1 mol·L-1的氨水两种溶液等体积混合,所得溶液的pH 7(填“大于”、“小于”或“等于”),原因是(用离子方程式表示) ;所得溶液中各离子的浓度由大到小的顺序是 。
19.(12分)甲醇(CH3OH)是一种重要的化工原料,广泛应用于化工生产,也可以直接用做燃料。已知CH3OH(l )+O2(g)===CO(g)+2H2O(g) △Ha=-443.64kJ·mol-1
2CO(g)+O2(g)===2CO2(g) △Hb=566.0 kJ·mol-1
(1)试写出CH3OH(l )在氧气中完全燃烧生成CO2和H2O(g)的热化学方程式:
(2)科研人员新近开发出一种由强碱做电解质溶液的新型甲醇手机电池,可使手机连续使用一个月才充一次电,据此回答下列问题:
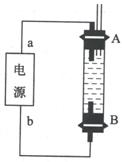
甲醇在 极反应;电极反应式为
(3)利用电池可实现电能向化学能转化。某同学设计了一种电解法制取Fe(OH)2的实验装置,通电后,溶液中产生大量的白色沉淀,且较长时间不变色。下列说法中正确的是 (填序号)。
A.电源中的a一定为正极,b一定为负极[
B.可以用NaCl作为电解液
C.A、B两端都必须用铁做电极
D.阴极发生的反应是2H++2e-=H2↑[
18.由NaCl和CuSO4组成的混合溶液中C(Na+)=3(Cu2+)=0.3 mol·L-1,取该混合液100 mL用石墨做电极进行电解,通电一段时间后,在阴极收集到0.112L(标准状况)气体。若溶液体积仍为100 mL,此时溶液的pH为( )
A.14 B.2 C.12 D.13
第II卷(共46分)
17.一定条件下,电解较稀浓度的硫酸,其还原物为双氧水,该原理可用于制取双氧水,其电解的化学方程式为:3H2O+3O2===O3+3H2O2.下列有关说法正确的是( )
A.电解池的阳极生成双氧水,阴极生成臭氧
B.电解池中硫酸溶液的pH保持不变
C.产生臭氧的电极反应式为3H2O-6e-===O3+6H+
D.产生双氧水的电极反应式为2H2O-2e-===H2O2+2H+
16.用惰性电极进行电解,下列说法正确的是( )
A.电解稀硫酸溶液,实质上是电解水,故溶液pH不变
B.电解稀NaOH溶液,要消耗OH-,故溶液pH减小
C.电解Na2SO4溶液,在阴极上和阳极上析出产物的物质的量之比为1∶2
D.电解CuCl2溶液,在阴极上和阳极上析出产物的物质的量之比为1∶1
15.根据金属活动性顺序表,Cu不能发生Cu+2H2O===Cu(OH)2+H2↑的反应。但选择恰当电极材料和电解液进行电解,这个反应就能实现。下列四组电极和电解液中,能实现该反应最为恰当的是( )
阳极 阴极 电解液 阳极 阴极 电解液
A.石墨棒 石墨棒 CuSO4溶液 B.Cu 石墨棒 Na2SO4溶液
C.Cu Fe H2SO4溶液 D.Cu Pt H2O
14.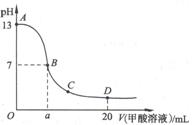 在15mL
0.1 mol·L-1KOH溶液中逐滴加入0.2
mol·L-1甲酸溶液,溶液pH和加入的甲酸的体积关系曲线如图所示,有关粒子浓度大小关系正确的是( )
在15mL
0.1 mol·L-1KOH溶液中逐滴加入0.2
mol·L-1甲酸溶液,溶液pH和加入的甲酸的体积关系曲线如图所示,有关粒子浓度大小关系正确的是( )
A.在A、B间任意一点,c(K+)>c(HCOO-)>c(OH-)>c(H+)
B.在B点:c(K+)>c(HCOO-)>c(OH-)>c(H+),且a=7.5
C.在C点:c(HCOO-)>c(K+)>c(OH-)>c(H+)
D.在D点:c(HCOO-)+ c(HCOOH)>2c(K+)
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com