
题目列表(包括答案和解析)
2.只用滴管、试管和水就能鉴别的物质组是( )
A.苯、乙酸、CCl4 B.乙醇、乙醛、乙酸
C.乙二醇、乙醛、溴代烃 D.乙醇、甘油、苯酚
1.目前车用乙醇汽油正逐步推广使用。它是把变性燃料乙醇和汽油按一定比例混配形成的一
种新型汽车燃料。经多项检测结果表明,它不影响汽车的行驶性能,还可以减少有害气体
的排放量。下列有关乙醇汽油的说法正确的是( )
A.乙醇汽油是一种纯净物 B.乙醇汽油作燃料不会产生碳氧化合物等有害气体
C.乙醇和汽油都可作溶剂,也可相互溶解 D.乙醇和乙二醇互为同系物
5. (8分)在温度一定,压强不变的密闭容器内,发生合成氨的反应:
N2+3H2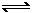 2NH3
2NH3
若充入1molN2和3molH2,反应达到平衡时NH3的体积百分含量为W%。若改变开始时投入原料的量,加入amolN2,bmolH2,cmolNH3,反应达到平衡时,NH3的体积百分含量仍为W%,则:
①.若a=b=0, c=
②.若a=0.75, b= , c=
③.若温度、压强恒定,则 a、b、c必须满足的关系是
4.(3分)在25℃时浓度均为1 mol/L 的(NH4)2SO4、(NH4)2CO3、(NH4)2Fe(SO4)2(硫酸亚铁铵)三种溶液中,测得三种溶液中c(NH4+)分别为 a、b、c(mol/L),则下列判断正确的是 ( )
A、a>b>c B、a>c>b C、b>a>c D、c>a>b
3.(3分)在恒温时,一固定容积的容器内发生如下反应:2NO2(g)

 N2O4(g)达平衡时,再向容器内通入一定量的NO2(g),重新达到平衡后,与第一次平衡时相比, NO2的体积分数
( )
N2O4(g)达平衡时,再向容器内通入一定量的NO2(g),重新达到平衡后,与第一次平衡时相比, NO2的体积分数
( )
A.不变 B.增大 C.减小 D.无法判断
2.(3分)用惰性电极分别电解下列各物质水溶液一段时间后,向剩余电解质溶液中加入适量水,能使溶液恢复到电解前浓度的是 ( )
A.AgNO3 B.Na2SO4 C.CuCl2 D.HCl
1.(3分)PH= 4的H2SO4溶液与PH= 4的NH4NO3溶液,由水电离出的H+浓度的比值是 ( )
A.1 B.106 C.10-6 D.10-5
20.
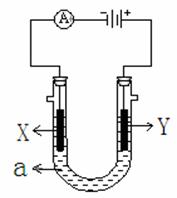 (20分)电解原理在化学工业中有广泛应用。右图表示一个电解池,装有电解液a ;X、Y是两块电极板,通过导线与直流电源相连。请回答以下问题:
(20分)电解原理在化学工业中有广泛应用。右图表示一个电解池,装有电解液a ;X、Y是两块电极板,通过导线与直流电源相连。请回答以下问题:
⑴ 若X、Y都是惰性电极,a是饱和NaCl溶液,实验开始时,同时在两边各滴入几滴酚酞试液,则
① 电解池中X极上的电极反应式为 。
在X极附近观察到的实验现象是 。
② Y电极上的电极反应式为 。
③ 总反应方程式: ;
⑵ 若要在铁制品上镀一定厚度的银层
① X电极材料是 (填铁或银);
② a是 溶液
③ Y电极反应方程式: ;
⑶ 若X、Y都是铂电极,电解某金属的氯化物(XCl2)溶液,当收集到1.12 L氯气时(标准状况),阴极增重3.2 g .
① 该金属的相对原子质量是 ;
② 电路中有 mol电子通过。
附加题(本题包括5小题,共20分)
19.(12分)某学生用标准的0.2mol/L的盐酸滴定待测的NaOH溶液,其实验操作如下:
A.用碱式滴定管取待测液NaOH溶液放入锥形瓶,滴加2-3滴酚酞指示剂。
B.用待测的NaOH溶液润洗碱式滴定管。
C.把滴定管用蒸镏水洗净。
D.取下酸式滴定管,用标准的盐酸溶液润洗后,再将标准的盐酸注入酸式滴定管至刻
度“0”以上2cm-3cm处,把酸式滴定管固定好,调节液面。
E.检查滴定管是否漏水,并分别固定在滴定管架两边。
F.另取锥形瓶,再重复滴定操作一次。
G.把锥形瓶放在酸式滴定管的下面,瓶下垫一张白纸,然后边滴定边摇动锥形瓶,直
至终点,记下滴定管的液面所在刻度。
据上述滴定操作,完成下列填空:
⑴ 滴定操作的正确操作顺序是(用上述各编号字母填写)
→E→ →B→ → → ;
⑵ G步操作中判断滴定终点的依据是 ;
⑶ D步骤的操作中液面应调节到 ,尖嘴部分应 ;
⑷ 酸式滴定管未用标准的盐酸润洗,待测溶液NaOH的测定值会 ;
碱式滴定管未用待测的NaOH溶液润洗,待测NaOH溶液的测定值会 。
(填“偏高”、“偏低”或“无影响”。)
18.(12分)在某温度下,将H2和I2各0.10mol 的气态混合物充入10L的密闭容器中,充分反应,达到平衡后,测得c(H2)= 0.0080 mol·L-1
(1)该反应的平衡常数K= (填数值)。
(2)在上述温度下,该容器中若通入H2和I2蒸气各0.20 mol,达到化学平衡状态时:
c(H2) = mol ·L-1; c(HI) = mol·L-1。

湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com