
题目列表(包括答案和解析)
2.过滤过程中若发现滤液浑浊,可检查滤纸是否破损、烧杯是否洗干净、过滤时液面是否低于滤纸的边缘等。
3.氯化钠在自然界的存在
海水、盐湖、盐井和盐矿中都蕴藏着氯化钠。用海水晒盐或用井水、盐湖水煮盐,都可以使水分蒸发,使食盐溶液得到饱和,再继续蒸发就可以析出食盐晶体,这样得到的食盐含有较多杂质,叫做粗盐。要想得到纯净的食盐,需要提纯。
活动与探究:
实验原理:将粗盐溶解,过滤除去不溶物,再将滤液蒸发结晶。
实验仪器:量筒、托盘天平、小烧杯、药匙、胶头滴管、玻璃棒、酒精灯、铁架台、蒸发皿、滤纸。
实验药品:蒸馏水、粗盐。
实验装置:如下图。

实验过程:
|
步骤 |
现象 |
结论 |
|
(1)溶解:量取10 mL蒸馏水倒入烧杯,用天平称取5.0 g粗盐加入烧杯中,充分搅拌 |
烧杯中得到浑浊的液体 |
通过溶解、过滤、 蒸发等操作,可 除去粗盐中不溶性杂质 |
|
(2)过滤:制作好过滤器,将烧杯中浑浊的液体沿着玻璃棒慢慢倒入漏斗 |
滤液变澄清, 滤纸上有大量泥沙等 |
|
|
(3)蒸发:将滤液倒入蒸发皿中,用酒精灯加热,并不断用玻璃棒搅拌,当出现多量固体时停止加热,利用余热把食盐烘干 |
蒸发皿中出现大 量白色物质 |
|
|
(4)计算产率:用玻璃棒把固体转移到纸上,称量后,倒入指定容器,计算产率 |
所得食盐的质量 比粗盐少 |
实验说明:1.过滤操作的要点是一贴、二低、三靠。
一贴:滤纸要紧贴在漏斗内壁上,中间不要留有气泡;
二低:液面低于滤纸边缘,滤纸边缘低于漏斗边缘;
三靠:玻璃棒要紧靠漏斗中三层滤纸处,盛混合液的烧杯口要紧靠在玻璃棒上,漏斗的末端要紧靠在盛接滤液的烧杯内壁上。
2.氯化钠的用途
(1)医疗上用氯化钠配制生理盐水(质量分数为0.9%)。
(2)农业上用一定质量分数的氯化钠溶液来选种。
(3)工业上用氯化钠原料制取化工产品。
(4)生活中用于腌制食品等。
(5)用于使公路上的积雪融化。
(6)是重要的调味品,被称为调味剂(调味品之王)。
(7)是化工原料等。
状元笔记
医生给病人注射生理盐水,目的就是补充Na+和Cl-,以维持人体的正常生理活动。
1.氯化钠对人体的作用
食盐的主要成分是氯化钠。氯化钠是白色固体,易溶于水,其水溶液呈中性(pH=7)。氯化钠在水溶液中电离出的Na+和Cl-对人体的正常生命活动起着重要的调节作用。Na+对维持细胞内外正常的水分分布和促进细胞内外物质交换起着主要作用;Cl-是胃液中的主要成分,具有促生盐酸、帮助消化和增进食欲的作用。所以,人们每天都要摄入一些食盐,但长期食用过多食盐也不利于人体健康。
探究:由于核外电子的排布知识同学们了解不多,因此对于离子的形成、离子所带电荷理解起来有一定难度。认识离子的有关知识,应从以下几个方面入手:(1)离子的形成是原子得到或失去电子的产物。原子得到电子,自身带上负电荷,形成阴离子;失去电子,带上正电荷,形成阳离子,所以离子是带电的原子;(2)离子是构成物质的一种微粒。同种电荷相互排斥,异种电荷相互吸引,阳离子和阴离子之间既相互吸引又相互排斥(核与核之间、电子与电子之间相互排斥),正是由于这种“相互作用”,才构成了物质。如氯化钠(俗称食盐)就是由钠离子和氯离子构成的;(3)离子得到或失去电子后可重新变成原子。
[例题2]填写下图中的空白。

解析:镁原子质子数为12,最外层有2个电子,在化学反应中易失去最外层的2个电子,形成带2个单位正电荷的阳离子,离子符号为Mg2+。
答案:(1)Mg (2)2 (3)失 (4)Mg2+(5)MgCl2
绿色通道:本题主要考查了离子的形成。元素的化学性质由最外层电子数决定,最外层电子得失后形成离子,得失电子的数值即为离子所带电荷数。
针对训练:
3.下列关于原子、分子和离子的叙述中正确的是( )
A.原子是不能再分的最小粒子
B.分子是可分的,它是能保持物质化学性质的唯一粒子
C.原子失去电子,形成的离子一定是阳离子
D.非金属原子在化学反应中一定获得电子,变为阴离子
答案:C 解析:原子由原子核和核外电子构成(在化学变化中,原子不可分),故A错;由原子构成的物质,原子也能保持物质的化学性质,故B错;原子失去电子,质子数大于电子数,带正电荷,为阳离子,故C正确;非金属原子在化学反应中也可以失去电子,形成阳离子,故D错。
2.据《自然》杂志报道,科学家最近研制的一种以锶原子做钟摆的钟是世界上最精确的钟。锶元素(元素符号为Sr)原子结构示意图为: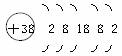 ?
?
锶元素属于________________(填“金属”或“非金属”)元素,锶原子的核内质子数为________________,原子核外有________________个电子层,锶离子的符号为_____________。
解析:根据锶元素的原子结构示意图,该原子的质子数为38(圈内数值),原子核外有5个电子层,最外层电子数为2,在化学变化中易失去2个电子,形成阳离子,离子符号为Sr2+,锶元素属于金属元素。
答案:金属 38 5 Sr2+
探究:原子中的电子绕核高速运转,电子按能量的大小分层排布,能量小的在离核较近的电子层上运动,能量较高的在离核较远的电子层上运动,先排第一层再排第二层,以此类推,第一层上最多排2个电子,第二层最多排8个电子,最外层最多排8个电子。原子中电子的排布通常用原子结构示意图表示。如:
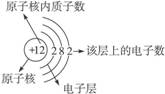
分析原子结构示意图获得的信息是:(1)金属原子易失电子;(2)非金属原子易得电子;(3)稀有气体原子不易得电子,也不易失电子;(4)原子的化学性质是由原子的最外层电子数决定的。
[例题1]现有三种粒子结构示意图: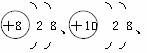
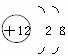 ,下列有关说法中正确的是( )
,下列有关说法中正确的是( )
A.它们表示同一种元素 B.它们都是具有相对稳定结构的原子
C.它们都带有电荷 D.它们的核外电子数相同
解析:本题主要考查原子结构示意图表示的意义。在化学上,质子数决定元素的种类,质子数相同的原子和离子属于同种元素。把粒子最外层有8个电子的结构(只有一个电子层的最外层为2个电子)称为稳定结构,具有相对稳定结构的粒子可能是原子也可能是离子。可根据粒子结构示意图中粒子的质子数与核外电子数的关系来确定粒子是原子、阳离子或阴离子,即在结构示意图中,质子数=核外电子数,该粒子是原子;质子数>核外电子数,该粒子是阳离子;质子数<核外电子数,该粒子是阴离子。核外电子数相等的粒子可能是不同元素的原子与离子或离子与离子。所以本题选D。
答案:D
黑色陷阱:本题常出现的错误有:一是认为粒子的核外电子数相同就是同种原子,从而导致错选A;二是错误地认为8电子的相对稳定结构都是由原子通过得失电子形成的,原子就应带有电荷,从而导致错选C。
针对训练:
1.某元素的原子结构示意图为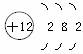 。小红对它的认识中错误的是( )
。小红对它的认识中错误的是( )
A.原子核内有12个质子 B.原子核外有3个电子层
C.该元素属于金属元素 D.该原子失去电子后带负电荷
答案:D 解析:由原子结构示意图可知,原子核内质子数为12,核外有3个电子层,最外层电子数为2,该元素属于金属元素,A、B、C正确;原子失去电子后带正电荷,D错误。
3.答案:阳离子(Na+) 氯的阴离子(Cl-) 相互作用
师生互动
2.答案:右上方 数值 正负号
1.答案:带电荷的原子(或原子团) 正电荷 负电荷
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com