
题目列表(包括答案和解析)
7.将铁粉和硫粉混合后加热,待反应一发生即停止加热,反应仍可持续进行,直至反应完全生成新物质硫化亚铁。该现象说明
A.该反应为吸热反应
B.该反应为放热反应
C.铁粉和硫粉在常温下难以发生反应
D.生成物硫化亚铁的总能量高于反应物铁粉和硫粉的总能量
6. 根据以下3个热化学方程式:
2H2S(g)+3O2(g)=2SO2(g)+2H2O(l) △H=―Q1 kJ/mol
2H2S(g)+O2(g)=2S (s)+2H2O(l) △H=―Q2 kJ/mol
2H2S(g)+O2(g)=2S (s)+2H2O(g) △H=―Q3 kJ/mol
判断Q1、Q2、Q3三者关系正确的是
A. Q1>Q2>Q3 B. Q1>Q3>Q2 C. Q3>Q2>Q1 D. Q2>Q1>Q3
5.
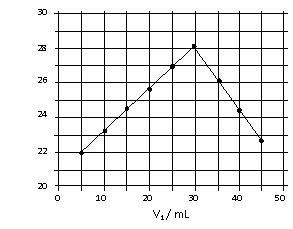 将V1mL1.0mol/L
HCl溶液和V2mL未知浓度的NaOH溶液混合均匀后测量并记录溶液温度,实验结果如右图所示(实验中始终保持V1+V2=50mL)。下列叙述正确的是
将V1mL1.0mol/L
HCl溶液和V2mL未知浓度的NaOH溶液混合均匀后测量并记录溶液温度,实验结果如右图所示(实验中始终保持V1+V2=50mL)。下列叙述正确的是
A.做该实验时环境温度为22℃
B.该实验表明化学能可能转化为热能
C. NaOH溶液的浓度约为1.0mol/L
D.该实验表明有水生成的反应都是放热反应
4.下列热化学方程式中的△H能表示物质燃烧热的是( )
A.2CO(g) + O2 (g) == 2CO2(g) ; △H = -556kJ·mol-1
B.CH4 (g) + 2O2(g) == CO2 (g) + 2H2O(l) ; △H = -890kJ·mol-1
C.H2 (g) +1/2O2(g) == H2O(g) ; △H = -241.8kJ·mol-1
D.H2(g) + Cl2(g) == 2HCl(g) ; △H = -184.6kJ·mol-1
3. 已知下列化学键的键能(kJ/mol):C-C 346;C=C 610;H-H 436;C-H 413。则反应:CH2=CH2 + H2 → CH3CH3 的反应热为:
A.126kJ B.+126kJ/mol C.-126kJ/mol D.126kJ/mol
2.下列说法正确的是
A. 物质发生化学反应都伴随着能量变化
B. 伴有能量变化的物质变化都是化学变化
C. 需要加热才能进行的化学反应一定是吸热反应
D. 在一个确定的化学反应关系中,反应物的总能量总是高于生成物的总能量
1. 天然气、石油、煤等在地球上的蕴藏量是有限的,因此:①可利用电解水的方法得到氢气作新型能源;②可用电解氧化铝得到铝作新型能源;③砍伐树木作能源;④应开发太阳能、核能等新的能源;⑤将煤进行液化和汽化处理,提高煤的燃烧效率。上述说法正确的是
A.①②④⑤ B.①④ C.②和③ D.④⑤
14、(17分)影响化学反应速率的因素很多,某课外兴趣小组用实验的方法通过图1所示装置研究反应速率的有关问题。
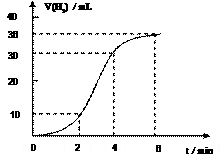
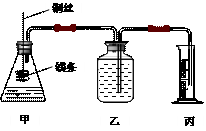
图1 图2
(1)取一段镁条,用砂纸擦去表面的氧化膜,使镁条浸入锥形瓶内足量的稀盐酸中。足量镁条与一定量盐酸反应生成H2的量与反应时间的关系曲线如图2所示。
①请在图3 的方框中画出上述反应的速率(mL/min)与时间(min,)的关系曲线。
图3
②在前4min内,镁条与盐酸的反应速率逐渐加快,在4min之后,反应速率逐渐减慢,请简述其原因:____________________________________________ 。
(2)某同学发现,纯度、质量、表面积都相同的两铝片与H+浓度相同的盐酸和硫酸在同温同压下反应时产生氢气的速率差别很大,铝和盐酸反应速率更快。他决定对其原因进行探究。填写下列空白:
①该同学认为:由于预先控制了反应的其他条件,那么,两次实验时反应的速率不一样的原因,只有以下五种可能:
原因Ⅰ:Cl-对反应具有促进作用,而SO42-对反应没有影响;
原因Ⅱ:_______________________________________________________;
原因Ⅲ:Cl-对反应具有促进作用,而SO42-对反应具有阻碍作用;
原因Ⅳ:Cl-、SO42-均对反应具有促进作用,但Cl-影响更大;
原因Ⅴ:________________________________________________________。
②该同学设计并进行了两组实验,即得出了正确结论。他取了两片等质量、外形和组成相同、表面经过砂纸充分打磨的铝片,分别放入到盛有同体积、c(H+)相同的稀硫酸和盐酸的试管(两试管的规格相同)中:
a.在盛有硫酸的试管中加入少量NaCl或KCl固体 ,观察反应速率是否变化;
b.在盛有盐酸的试管中加入少量Na2SO4或K2SO4固体,观察反应速率是否变化。
若观察到实验a中____________ _________,实验b中____________________________,则说明原因Ⅲ是正确的。依次类推。该同学通过分析实验现象,得出了结论:Cl-对反应具有加速作用。
选修4第二章《化学反应速率和化学平衡》测试题
13.在80℃时,将0.4mol的四氧化二氮气体充入2L已抽空的固定容积的密闭容器中,隔一段时间对该容器内的物质进行分析,得到如下数据:
|
时间(s) C(mol/L) |
0 |
20 |
40 |
60 |
80 |
100 |
|
C(N2O4) |
0.20 |
a |
0.10 |
c |
d |
e |
|
C(NO2) |
0.00 |
0.12 |
b |
0.22 |
0.22 |
0.22 |
反应进行至100s后将反应混合物的温度降低,发现气体的颜色变浅。
(1)该反应的化学方程式为 ,表中b c(填“<”、“=”、“>”)。
(2)20s时,N2O4的的浓度为 mol/L,0~20s内N2O4的平均反应速率为 。
(3)该反应的平衡常数表达式K= ,在80℃时该反应的平衡常数K值为 (保留2位小数)。
(4)在其他条件相同时,该反应的K值越大,表明建立平衡时 。
A、N2O4的转化率越高 B、NO2的产量越大
C、N2O4与NO2的浓度之比越大 D、正反应进行的程度越大
12.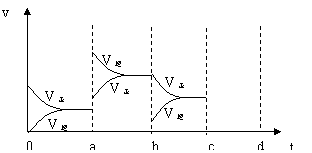 (9分)下图表示在密闭容器中反应:2SO2+O2
(9分)下图表示在密闭容器中反应:2SO2+O2 2SO3,
△H <
0达到平衡时,由于条件改变而引起反应速度和化学平衡的变化情况,a b过程中改变的条件可能是 ;b c过程中改变的条件可能是
; 若增大压强时,反应速度变化情况画在c~d处.。
2SO3,
△H <
0达到平衡时,由于条件改变而引起反应速度和化学平衡的变化情况,a b过程中改变的条件可能是 ;b c过程中改变的条件可能是
; 若增大压强时,反应速度变化情况画在c~d处.。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com