
题目列表(包括答案和解析)
4.已知:H2(g)+F2(g) === 2HF(g) △H=-270kJ,下列说法正确的是( )
A.1个氢气分子与1个氟气分子反应生成2个氟化氢分子放出270kJ
B.1mol氢气与1mol氟气反应生成2mol液态氟化氢放出的热量小于270kJ
C.在相同条件下,1mol氢气与1mol氟气的能量总和大于2mol氟化氢气体的能量
D.2mol氟化氢气体分解成1mol的氢气和1mol的氟气放出270kJ热量
3.已知热化学方程式:
H2O(g)=H2(g) + 1/2O2(g) △H = +241.8kJ/mol
H2(g)+ 1/2O2(g) = H2O(1) △H = -285.8kJ/mol
当1g液态水变为水蒸气时,其热量变化是( )
A.吸热88kJ B. 吸热2.44KJ C.放热44kJ D. 吸热44KJ
|
 A. C6H12O6(葡萄糖aq)+6O2
6CO2+6H2O
A. C6H12O6(葡萄糖aq)+6O2
6CO2+6H2O
B. CH3COOH+KOH CH3COOK+H2O
CH3COOK+H2O
C. 反应物的总能量大于生成物的总能量
D.破坏反应物全部化学键所需能量大于破坏生成物全部化学键所需能量
2.下列说法正确的是( )
A.热化学方程式中,如果没有注明温度和压强,则表示反应热是在标准状况下测得的数据
B.升高温度或加入催化剂,可以改变化学反应的反应热
C.据能量守恒定律,反应物的总能量一定等于生成物的总能量
D.物质发生化学变化一定伴随着能量变化
16. 依据事实,写出下列反应的热化学方程式。
(1)在25℃、101kPa下,1g甲醇燃烧生成CO2和液态水时放热22.68kJ。则表示甲醇燃烧热的热化学方程式为___________________________________________。
(2)若适量的N2和O2完全反应,每生成23g NO2需要吸收16.95kJ热量
_______________________________________________________________。
(3)已知拆开1mol H-H键,1molN-H键,1molN≡N键分别需要的能量是436kJ、391kJ、946kJ,则N2与H2反应生成NH3的热化学方程式为________________________________
15.(13分)已知:下列两个热化学方程式:
Fe(s)
+ 1/2O2(g)  FeO(s)
FeO(s)  =-272.0KJ/mol
=-272.0KJ/mol
2Al(s)
+ 3/2O2(g)  Al2O3(s)
Al2O3(s)  =-1675.7KJ/mol
=-1675.7KJ/mol
则 Al(s)的单质和FeO(s)反应的热化学方程式是_____________________________________。
14.常温常压下,断裂1mol(理想)气体分子化学键所吸收的能量或形成1mol(理想)气体分子化学键所放出的能量称为键能(单位为KJ.mol-1)下表是一些键能数据(KJ·mol-1)
|
化学键 |
键能 |
化学键 |
键能 |
化学键 |
键能 |
化学键 |
键能 |
|
C-H |
414 |
C-F |
489 |
H-F |
565 |
F-F |
158 |
|
H-H |
436 |
H-N |
391 |
|
|
|
|
(1)根据键能数据计算以下反应的反应热△H:
CH4(g)+4F2(g)﹦CF4(g)+4HF(g) △H
(2)根据键能和反应热化学方程式1/2N2(g)+3/2H2(g) =NH3(g ) △H = -46 kJ·mol-1 计算N≡N的键能。
13. 已知热化学方程式:
① C2H2(g) +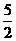 O2(g) == 2CO2(g)+H2O(l) ΔH1=-1301.0 kJ•mol-1
O2(g) == 2CO2(g)+H2O(l) ΔH1=-1301.0 kJ•mol-1
② C(s)+ O2(g) == CO2(g) △H2=-393.5 kJ•mol-1
③ H2(g)+ O2(g) == H2O(1) △H3 = -285.8 kJ·mol-1
则反应④ 2C(s)+ H2(g) == C2H2(g)的△H为( )
A. +228.2 kJ·mol-1 B. -228.2 kJ·mol-1
C. +1301.0 kJ·mol-1 D. +621.7 kJ·mol-1
12.已知
(1)H2(g)+1/2O2(g)===H2O(g) △H1=a kJ·mol-1
(2)2H2(g)+O2(g)===2H2O(g) △H2=b kJ·mol-1
(3)H2(g)+1/2O2(g)===H2O(l) △H3=c kJ·mol-1
(4)2H2(g)+O2(g)===2H2O(l) △H4=d kJ·mol-1
下列关系式中正确的是( )
A.a<c<0 B.b>d>0 C.2a=b<0 D.2c=d>0
11. 已知H2(g)、C2H4(g)和C2H5OH(1)的燃烧热分别是285.8kJ·mol-1、1 411.0kJ·mol-1和1 366.8 kJ·mol-1,则由C2H4(g)和H2O(l)反应生成C2H5OH(l)的△H为( )
A. -44.2 kJ·mol-1 B. +44.2 kJ·mol-1
C. -330 kJ·mol-1 D. +330 kJ·mol-1
10. 下列关于中和热的说法不正确的是( )
A.已知下列热化学方程式:2H2(g)+O2(g) === 2H2O(g) △H=-484kJ•mol-1,
则氢气的燃烧热为242kJ•mol-1
B.中和反应的实质是H+ 与OH-结合生成水,若有其它物质生成,这部分反应热不在中和热内
C.物质的燃烧热可利用仪器由实验测得
D.中和热不包括物质溶解、电离、水合等过程中的热效应
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com