
题目列表(包括答案和解析)
5.下列物质属于电解质的是
A.汽油 B.Cl2 C.NaCl D.酒精
4.人体血红蛋白中含有Fe2+离子,如果误食亚硝酸盐,会使人中毒,因为亚硝酸盐会使Fe2+离子转变成Fe3+离子,生成高铁血红蛋白而丧失与O2结合的能力。服用维生素C可缓解亚硝酸盐的中毒,这说明维生素C具有
A.酸性 B.碱性 C.氧化性 D.还原性
3.下列物质转化需要加入还原剂才能实现的是
A.SO32-→SO2 B.HCl→Cl2
C.Na→Na+ D.SO2→S
2.气体标准状况下的摩尔体积为
A.22.4 B.22.4 L / mol C.22.4L D.22.4mol
1.下列叙述中正确的是
A.1mol氧 B.2mol分子氧 C.3mol原子氧 D.4molO2
(1)B是__Fe2O3________,H是_Fe(OH)2______________。(填化学式)
(2)写出J与D反应转化为G的离子方程式: 2Fe3++Fe=3Fe2+ .
(3)A在常温下也可与NaOH溶液反应生成F,写出此反应的离子方程式 :
2Al + 2OH- + 2H2O = 2AlO2- + 3H2
(4)写出H 生成 I的反应方程式:4Fe(OH)2 +O2 + 2H2O = 4Fe(OH)3 .
28.根据上述操作回答下列问题:
(1)原溶液中肯定存在的离子是:CO32-,AlO2-,SO42-,Na+
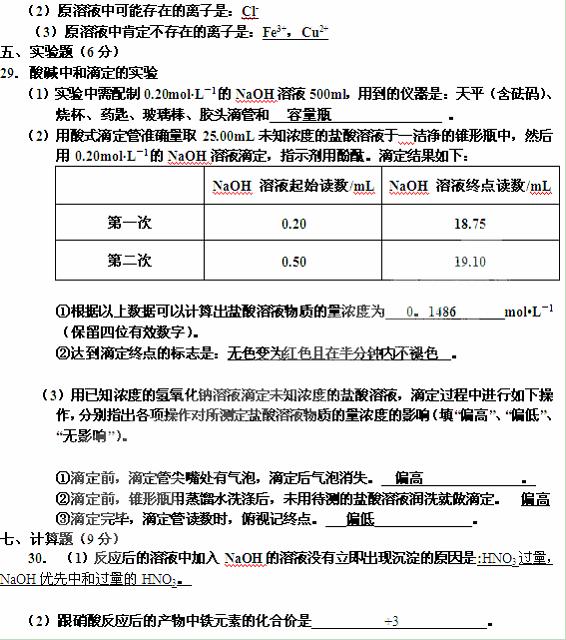
(3)图形中DEF先平后下折的原因是: NaOH先与NH4NO3作用产生NH3后,再溶解Al(OH)3__ 。
(4)纵坐标中A点的数值是___0.856 g ___。原稀硝酸的浓度是___0.72mol/L ___ 。
26、写出下列反应的化学方程式:
1) 丙烯通入溴水中 ;
2) 1-丁烯与H2气进行加成 ;
3) 2-丁烯发生加聚反应 ;
30. 硝酸跟金属反应时,随着硝酸的浓度下降和金属活动性的增大,产物中氮元素的化合价会逐渐下降,它们可能是NO2、NO、N2O、N2或NH3中的一种或几种。现有一定量铁粉和铝粉组成的混合物跟100ml稀硝酸充分反应,反应过程中无任何气体放出,在反应结束后的澄清溶液中,逐渐加入4.00mol/L的氢氧化钠溶液,加入氢氧化钠溶液的体积与产生沉淀的质量如图所示:
请回答:
(1)反应后的溶液中加入NaOH的溶液没有立即出现沉淀的原因是:________________。
(2)跟硝酸反应后的产物中铁元素的化合价是__________。
(3)图形中DEF先平后下折的原因是_______________________________
(4)纵坐标中A点的数值是________________。原稀硝酸的浓度是______________。


29.酸碱中和滴定的实验
(1)实验中需配制0.20mol·L-1的NaOH溶液500ml,用到的仪器是:天平(含砝码)、烧杯、药匙、玻璃棒、胶头滴管和 。
(2)用酸式滴定管准确量取25.00mL未知浓度的盐酸溶液于一洁净的锥形瓶中,然后用0.20mol·L-1的NaOH溶液滴定,指示剂用酚酞。滴定结果如下:
|
|
NaOH 溶液起始读数/mL |
NaOH 溶液终点读数/mL |
|
第一次 |
0.20 |
18.75 |
|
第二次 |
0.50 |
19.10 |
①根据以上数据可以计算出盐酸溶液物质的量浓度为____________mol•L-1(保留四位有效数字)。
②达到滴定终点的标志是_________________。
(3)用已知浓度的氢氧化钠溶液滴定未知浓度的盐酸溶液,滴定过程中进行如下操作,分别指出各项操作对所测定盐酸溶液物质的量浓度的影响(填“偏高”、“偏低”、“无影响”)。
①滴定前,滴定管尖嘴处有气泡,滴定后气泡消失。________________。
②滴定前,锥形瓶用蒸馏水洗涤后,未用待测的盐酸溶液润洗就做滴定。___________。
③滴定完毕,滴定管读数时,俯视记终点。_________________。
28. 某溶液由Na+ 、Cu2+ 、Fe3+、AlO2- 、CO32-、SO42-、Cl-中的若干种离子组成,取适量该溶液进行如下实验:
(1)向其中加入过量盐酸,有气体生成,并得到无色透明溶液;
(2)在(1)所得溶液中加入过量氨水,产生白色沉淀,过滤;
(3)在(2)所得的滤液中加入过量氢氧化钡溶液,产生白色沉淀,过滤;
(4)在(3)所得滤液中加入过量的稀硝酸,再加入硝酸银溶液,产生白色沉淀。
根据上述操作回答下列问题:
(1)原溶液中肯定存在的离子是_______________;
(2)原溶液中可能存在的离子是_______________;
(3)原溶液中肯定不存在的离子是________________。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com