
题目列表(包括答案和解析)
1.能跟溴水反应生成白色沉淀的物质是
A.硝酸银溶液 B.乙烯 C.甲苯 D.苯酚
25.(8分)常温下将1molNH4Cl和0.2molNaOH溶于水配成1L溶液。
(1)该溶液中存在的4个平衡体系,写出任意两个:
、 。
(2)该溶液中Cl-浓度为 。
(3)该溶液中NH4+、NH3·H2O、NH3物质的量之和为 。
忻州市2009-2010学年第一学期高中会考
24.(12分)用中和滴定法测定烧碱的纯度,若烧碱中不含有与酸反应的杂质,试根据实验回答:
(1)用标准盐酸滴定待测烧碱溶液,取10.00mL待测液,用 量取。
(2)用0.2010mol·L-1标准盐酸滴定待测烧碱溶液,选用酚酞为指示剂,滴定时 手旋转 式滴定管的玻璃活塞, 手不停地摇动锥形瓶,两眼注视 ,直到滴入一滴标准盐酸时溶液立即由 色变成 色, 且半分钟内不褪色则达到滴定终点。
(3)用标准盐酸滴定未知浓度的NaOH,造成测定结果偏高的原因可能是 。
A.滴定终点读数时,俯视滴定管的刻度,其它操作均正确
B.盛装未知液的锥形瓶用蒸馏水洗过,未用待测液润洗
C.滴定到终点读数时发现滴定管尖嘴处悬挂一滴溶液
D.未用标准溶液润洗碱式滴定管
(4)根据下列数据,计算待测烧碱溶液的物质的量浓度为:______________________。
|
滴定次数 |
待测液体积(mL) |
标准盐酸体积(mL) |
|
|
滴定前读数mL) |
滴定后读数(mL) |
||
|
第一次 |
10.00 |
0.50 |
20.40 |
|
第二次 |
10.00 |
4.00 |
24.10 |
23.(10分)已知A为常见金属,X、Y为常见非金属,X、E、F、G常温下为气体(其中G为红棕色),C为无色液体,B是氯化铵。现用A与石墨作电极,B的浓溶液作电解质溶液,构成原电池。有关物质之间的转化如下图:(其中有些反应的条件及部分生成物略)
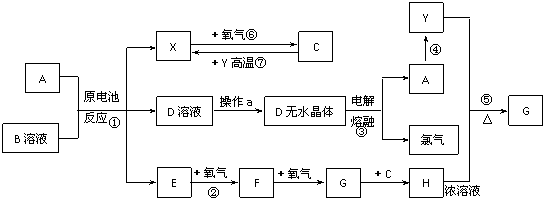
请填写下列空白:
(1)反应④为A在某种无色无味的气体中的燃烧,生成单质Y和A的氧化物,其反应方程式为: 。
(2)写出E与H反应产物水解的离子方程式: 。
(3)反应②的化学方程式为: 。
(4)G与C反应转化为H的离子方程式为: 。
(5)请用电子式表示出化合物D的形成过程:
。
22.(15分)在一定体积的密闭容器中,进行如下化学反应:
CO2(g)+H2(g) CO(g)+H2O(g),其化学平衡常数K和温度t的关系如下表:
CO(g)+H2O(g),其化学平衡常数K和温度t的关系如下表:
|
t℃ |
700 |
800 |
830 |
1000 |
1200 |
|
K |
0.6 |
0.9 |
1.0 |
1.7 |
2.6 |
回答下列问题:
(1)该反应的化学平衡常数表达式为K = 。
(2)该反应为 反应(选填吸热、放热)。
(3)能判断该反应是否达到化学平衡状态的依据是 (多选扣分)。
A.容器中压强不变 B.混合气体中 c(CO)不变
C.υ正(H2)=υ逆(H2O) D.c(CO2)=c(CO)
(4)某温度下,平衡浓度符合下式:c(CO2)·c(H2)=c(CO)·c(H2O),试判断此时的温度
为 ℃。
(5)某温度下,将CO和水蒸气各1mol置于密闭容器中反应,达到平衡后测得CO2为0.6mol,再通入4mol水蒸气,达到新的平衡后CO2的物质的量的范围是____________。
21.(15分)对下图中两极进行必要的连接并填空:
(1)在A图中,使铜片上冒H2气泡。则连接后的装置叫 。
电极反应式:
锌板: ;铜板: 。
(2)在B图中,a、b为惰性电极,使a极析出铜,则b极析出: 。加以必要的连接后,该装置叫 。
电极反应式:
a极: 。b极: 。
经过一段时间后,停止反应并搅匀溶液,溶液的pH (升高、降低、不变),加入一定量的 后(填化学式),溶液能恢复至与电解前完全一致。
(3)如将A图中Zn与Cu两极与B图中a、b作必要的连接后,也能产生与上完全相同的现象,则Zn极连 极,Cu极连 极(填a或b)。
20.将50 mL 0.5 mol/L的氯化铝溶液加入4. 0mol/L的氢氧化钠溶液可得到1.56g沉淀,则消耗氢氧化钠溶液的体积是
A.10mL B.20 mL C.30 mL D.40 mL
19.反应2SO2+O2 2SO3经一段时间后,SO3的浓度增加了0.4mol/L,在这段时间内用O2表示的反应速率为0.04 mol/(L·s)。则这段时间为
2SO3经一段时间后,SO3的浓度增加了0.4mol/L,在这段时间内用O2表示的反应速率为0.04 mol/(L·s)。则这段时间为
A.0.1s B.2.5s C.5s D.10s
18.25 ℃时,浓度均为0.3 mol/L的Na2CO3和NaHCO3溶液中,下列判断不正确的是
A.均存在电离平衡和水解平衡
B.存在的粒子种类相同
C.C(OH-)前者小于后者
D.分别加入NaOH固体,恢复到原温度,c(CO32-)均增大
17.常温下,现有pH=3的某酸HX溶液和pH=11某碱YOH溶液,两溶液混合后,溶液的pH小于7。下表中判断合理的是
|
编号 |
HX |
YOH |
溶液的体积关系 |
|
A |
强酸 |
强碱 |
V(HX)=V(YOH) |
|
B |
强酸 |
强碱 |
V(HX)<V(YOH) |
|
C |
强酸 |
弱碱 |
V(HX)=V(YOH) |
|
D |
弱酸 |
强碱 |
V(HX)=V(YOH) |
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com