
题目列表(包括答案和解析)
6. 250C时,在0.lmol/L的CH3COOH溶液中存在如下电离平衡:
CH3COOH  CH3COO-+H+对于该平衡,下列叙述正确的是
CH3COO-+H+对于该平衡,下列叙述正确的是
A.加入少量NaOH固体,溶液中c(H+)增大
B.加水,c(CH3COO-)和c(H+)增大
C.通入少量HCl,醋酸的电离常数减小
D.加入少量CH3COONa固体,溶液导电能力增强
5. 在粗制CuSO4·5H2O晶体中常含有杂质Fe2+。在提纯时,为了除去Fe2+,常加入少量H2O2,使Fe2+氧化为Fe3+,然后再加少量碱至溶液pH=4,可以达到除去铁离子而不损失硫酸铜的目的。由以上实验事实可知Fe(OH)3的相关性质是
A.溶度积常数小于Cu(OH)2 的溶度积常数
B.具有吸附性
C.溶度积常数大于Cu(OH)2的溶度积常数
D.溶度积常数等于Cu(OH)2的溶度积常数
4. 相同温度下,物质的量浓度相同的四种溶液:①CH3COONa ;②NaHSO4;③NaCl;④Na2SiO3,按pH由大到小的顺序排列正确的是
A.④>①>③>② B.①>④>③>②
C.①>②>③>④ D.④>③>①>②
3.在由水电离产生的H+的浓度为1×10-13 mol/L的溶液中,一定能大量共存的离子组是
A.K+、Fe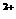 、I-、SO
、I-、SO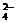 B.Na+、Cl-、NO
B.Na+、Cl-、NO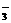 、SO
、SO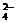
C.Na+、Ca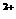 、Cl-、HCO
、Cl-、HCO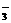 D.K+、Ba
D.K+、Ba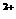 、S
、S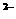 、NO
、NO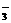

2. 电池是人类生产和生活中重要的能量来源。各式各样电池的发明是化学对人类的一项重大贡献。下列有关电池的叙述正确的是
A.手机上用的锂离子电池属于一次电池
B.铜锌原电池工作时,电子沿外电路从铜电极流向锌电极
C.氢氧燃料电池工作时氢气在负极被氧化
D.太阳能电池的主要材料是高纯度的二氧化硅
1. 2009年12月7日-18日在丹麦首都哥本哈根召开的联合国气候变化大会,被喻为是“拯救人类的最后一次机会”的会议。会议围绕CO2的排放量各国之间在相互指责的同时,也展开了激烈的谈判。其实要想从根本上减少CO2的排放,关键是要不断开发并使用对环境无污染或污染很小,且可以再生的新能源。下列属于新能源的是
①天然气 ②煤 ③氢能 ④石油 ⑤太阳能 A.①②④ B.③⑤
C.②③④ D.①②③④⑤
23. 1体积某烃的蒸气完全燃烧生成的CO2比生成的水蒸气少1体积(在同温同压下测定)。0.1mol该烃完全燃烧的产物被碱石灰吸收,碱石灰增重39 g。
(1)求该烃的分子式。
(2)若该烃的一氯代物有3种,写出该烃可能的结构简式。
22. 1,2-二溴乙烷可做汽油抗爆剂的添加剂,常温下它是无色液体,密度为2.18g •cm-3,沸点为131.4℃,熔点为9.79℃,不溶于水,易溶于有机溶剂。在实验室中可以用如图所示装置制备1,2-二溴乙烷。其中分液漏斗和烧瓶a中装有乙醇和浓硫酸的混合液,试管d中装有液溴(表面覆盖少量水)
填写下列空白:
(1)写出本题制备1,2-二溴乙烷的两个化学方程式及反应类型_______________________________
(2)为提高乙醇的利用率,烧瓶a中乙醇和浓硫酸的体积比为__________最适宜,浓硫酸的作用是_____________________
(3)容器c中NaOH溶液的作用是______________________________________________________
(4)某学生在做此实验时,使用一定量的液溴,当溴全部褪色时,所消耗乙醇和浓硫酸混合液的量,比正常情况下要超过许多。如果装置的气密性没问题,试分析其可能的原因(答出一个原因即可)_________________________________________________________________________
21.(8分)已知某溶液中只含有OH-、H+、NH4+、Cl-四种离子,某同学推测离子浓度大小顺序有如下四种关系:①c(Cl-)>c(NH4+)>c(H+)>c(OH-) ②c(Cl-)>c(NH4+)>c(OH-)>c(H+) ③c(NH4+)>c(Cl-) >c(OH-)>c(H+) ④c(Cl-) >c(H+)>c(NH4+)>c(OH-)。填写下列空白:
(1)若溶液中只溶解了一种溶质,则该溶质是__________,上述离子浓度大小顺序关系中正确的是________(填序号)
(2)若上述关系中③是正确的,则溶液中溶质的化学式是__________。若上述关系中④是正确的,则溶液中溶质的化学式是__________。
(3)若该溶液由体积相等的稀盐酸和氨水混合而成,且恰好呈中性,则混合前c(HCl) __ c (NH3·H2O) (填“>”、“<”或“=”符号),混合前盐酸中c(H+)和氨水中c(OH-)的关系为:c(H+)___c(OH-)(填“>”、“<”或“=”符号)。
20.(8分)由A、B、C、D四种金属按下表中装置进行实验。
|
装 置 |
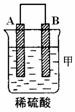 |
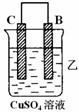 |
 |
|
现象 |
二价金属A不断溶解 |
C的质量增加 |
A上有气体产生 |
根据实验现象回答下列问题:
(1)装置甲中负极的电极反应式是___________________________________
(2)装置乙中正极的电极反应式是___________________________________
(3)装置丙中溶液的pH_______(填“变大”、“变小”或“不变”)
(4)四种金属活泼性由强到弱的顺序是_______________________________
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com