
题目列表(包括答案和解析)
4.在0.1 mol·L-1 CH3COOH溶液中存在如下电离平衡:
CH3COOH CH3COO- + H+,对于该平衡,下列叙述正确的是( )
CH3COO- + H+,对于该平衡,下列叙述正确的是( )
A.降温可以促进醋酸电离,会使氢离子浓度增大
B.加入少量NaOH固体,平衡向正反应方向移动
C.加入少量0.1 mol·L-1HCl溶液,溶液中c(H+)不变
D.加入少量CH3COONa固体,平衡向正反应方向移动
3.下列能正确表示水解的离子方程式是( )
A.CH3COOH + H2O 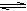 CH3COO- + H3O+ B.Br- + H2O
CH3COO- + H3O+ B.Br- + H2O 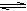 HBr + OH-
HBr + OH-
C.CO32- + 2H2O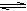 H2CO3 + 2OH- D.NH4+ + H2O
H2CO3 + 2OH- D.NH4+ + H2O 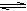 NH3·H2O
+ H+
NH3·H2O
+ H+
2.下列叙述正确的是( )
A.吸热反应一定是反应物总能量大于生成物的总能量
B.明矾和漂白粉常用于自来水的净化和杀菌消毒,两者的作用原理相同
C.强电解质溶液导电能力一定很强,弱电解质溶液导电能力一定很弱
D.在海轮外壳上镶入锌块,可减缓船体的腐蚀速率
1.下列状态时,不能导电的电解质是( )
A.液态氯化氢 B.熔融态的食盐 C.硫酸铜溶液 D.稀硫酸
26.空气中的SO2含量是重要的空气质量指标。在工业生产上规定:空气中二氧化硫的最大允许排放浓度不得超过0.02mg/L。
 Ⅰ:甲同学设计了如下图所示的实验装置,测定某地空气中SO2的含量:
Ⅰ:甲同学设计了如下图所示的实验装置,测定某地空气中SO2的含量:
(1)用上述装置测定空气中的SO2含量依据的化学反应原理是:
▲ (用化学方程式表示)。
(2)应用上述装置测定空气中的SO2含量,除测定气体流速(单位:cm3/min)外,还需要测定的数据是 ▲ 。
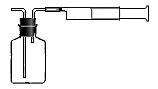 Ⅱ:乙同学拟用如右图简易装置测定空气中的SO2含量:准确移取一定体积的5×10-4mol/L的碘溶液,注入右图所示广口瓶中,加2-3滴淀粉指示剂,此时溶液呈蓝色。在指定的测定地点抽气,每次抽气100mL,直到溶液的蓝色全部褪尽为止,记录抽气次数(n)。
Ⅱ:乙同学拟用如右图简易装置测定空气中的SO2含量:准确移取一定体积的5×10-4mol/L的碘溶液,注入右图所示广口瓶中,加2-3滴淀粉指示剂,此时溶液呈蓝色。在指定的测定地点抽气,每次抽气100mL,直到溶液的蓝色全部褪尽为止,记录抽气次数(n)。
(3)若乙同学在实验室配制100 mL 5×10-4mol/L的碘溶液,需要用到的玻璃仪器是
▲ 。
(4) 如果乙同学用该方法测量空气中SO2的含量时,所测得的数值比实际含量低,你认为其中可能的原因(假设溶液配制、称量或量取及各种读数均无误)是:
▲ 。
Ⅲ:SO2的排放是造成酸雨的主要因素,丙同学通过实验探究,得出酸雨pH随时间的增加而减小的结论。为进一步研究酸雨的成分,丙同学取某一时段的这种雨水V L,加入0.5mol·L-1的Ba(OH)2溶液至不再产生沉淀时,恰好消耗40.00 mL Ba(OH)2溶液。请计算:
(5)该V L雨水中溶解SO2的体积是 ▲ mL(标准状况)。
(6)若生成沉淀物的质量为4.50 g,该雨水中含有H2SO3的物质的量浓度是多少?
25.(6分)下列物质A~F是我们熟悉的单质或化合物,其中A、B均是常见的金属,且A的合金用量最大;E在常温下是黄绿色气体;在适当的条件下,它们之间可以发生如下图所示的转化。
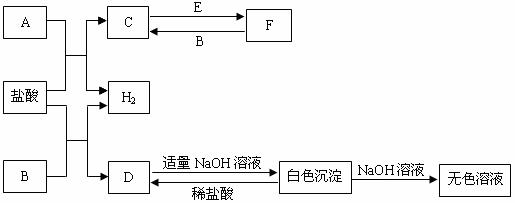
试回答下列问题:
⑴B在周期表中的位置是 ▲ ;
⑵检验F中金属阳离子的常用试剂是 ▲ 。
⑶白色沉淀与NaOH溶液反应的离子方程式是 ▲ 。
⑷反应C→F的化学方程式是 ▲ 。
24.(1)了解一些用药常识,有利于自我保健。青霉素、阿司匹林、碳酸镁均是生活中常用的药物。回答下列问题:
①可以帮助流感病人解热镇痛的药物是 ▲ 。
②青霉素在医疗上的主要作用是 ▲ 。
③碳酸镁可治疗胃酸过多的原理是 ▲ (用离子方程表示)。
(2)糖类、油脂、蛋白质都是人体必需的营养物质。油脂被摄入人体后,在酶的作用下水解为高级脂肪酸和______▲_____(写名称)。氨基酸是组成蛋白质的基本结构单元,其分子中一定含有的官能团是氨基(-NH2)和______▲______(写名称)。人体中共有二十多种氨基酸,其中人体自身_______▲______(填“能”或“不能”)合成的氨基酸称为人体必需氨基酸。淀粉在淀粉酶的作用下最终水解为 ▲ (写化学式),部分该产物在体内被氧化放出能量,供人体活动需要。
(3)材料通常可分为金属材料、无机非金属材料、高分子合成材料等。玻璃、陶瓷、
水泥属于 ▲ ,其生产原料不需要使用石灰石的是 ▲ 。
三大合成材料是指:塑料、合成纤维和 ▲ ;塑料制品造成的环境问题通常称为 ▲ 。钢铁在潮湿的空气中更容易被腐蚀,主要原因是其中的铁和碳构成许多微小的 ▲ ,发生电化学腐蚀。请提出一种防止钢铁腐蚀的措施 ▲ 。钛因具有耐酸、耐腐蚀等优良性能,被誉为“未来金属”。如果金属钛中混有少量铁杂质,可加入_____▲_______除去。
23.向体积为0.5L的AlCl3溶液中逐渐加入某浓度的NaOH溶液,得到的沉淀随NaOH溶液体积的变化如右图所示。下列结果正确的是
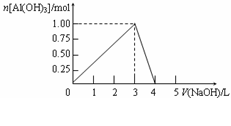 A.反应过程中,沉淀最多时的质量为7.8g
A.反应过程中,沉淀最多时的质量为7.8g
B.AlCl3溶液的浓度为2.0 mol/L
C.得到39g沉淀时,消耗的NaOH溶液体积
一定为1.5 L
D.当V(NaOHaq)=4.0 L时,得到的溶液中
Na+、Cl-浓度相等
第Ⅱ卷(非选择题 共31分)
22.下列物质中含有共价键的离子化合物是
A.H2 B.NaCl C.NaOH D.H2O
21.一种“即食即热型”快餐适合外出旅行时使用。它是利用两种物质发生化学反应对食物进行加热,这两种化学物质最合适的选择是
A.浓硫酸与水 B. 生石灰与水
C. 熟石灰与水 D. 氯化钠与水
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com