
题目列表(包括答案和解析)
5.焰色反应每次实验都要用某种试剂洗净铂丝,这种试剂是 ( )
(A) Na2CO3溶液 (B) NaOH溶液
(C) 硫酸 (D) 稀盐酸
4.测定芒硝(Na2SO4·10H2O)的结晶水含量。晶体灼烧后,确定结晶水是否完全失去的方法是 ( )
(A) 观察颜色变化 (B) 控制加热温度
(C) 恒重操作 (D) 观察是否有水生成
3.元素的性质呈周期性变化的根本原因是 ( )
(A) 元素原子量的递增,量变引起质变
(B) 元素的原子半径呈周期性变化
(C) 元素原子的核外电子排布呈周期性变化
(D) 元素的金属性和非金属性呈周期性变化
2.金属钠长期露置于空气中,最后变为 ( )
(A) 氧化钠 (B) 过氧化钠
(C) 碳酸钠 (D) 碳酸氢钠
1.下列氢氧化物中碱性最强的是 ( )
(A) KOH (B) NaOH
(C) LiOH (D) CsOH
22.(10分)合成气的主要成分是一氧化碳和氢气,可用于合成二甲醚等清洁燃料。从天然气获得合成气过程中可能发生的反应有:
①CH4(g)+H2O(g) CO(g)+3H2(g) ⊿H1=+206.1
kJ/mol
CO(g)+3H2(g) ⊿H1=+206.1
kJ/mol
②CH4(g)+CO2(g) 2CO(g)+2H2(g)
⊿H2=+247.3 kJ/mol
2CO(g)+2H2(g)
⊿H2=+247.3 kJ/mol
③CO(g)+H2O(g) CO2(g)+ H2(g) ⊿H3
CO2(g)+ H2(g) ⊿H3
请回答下列问题:
(1)在一密闭容器中进行反应①,测得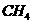 的物质的量浓度随反应时间的变化如图1所示。反应进行的前5min内,
的物质的量浓度随反应时间的变化如图1所示。反应进行的前5min内,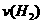 =
;10min时,改变的外界条件可能是
。
=
;10min时,改变的外界条件可能是
。

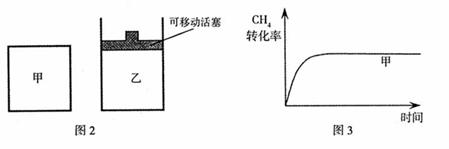
(2)如图2所示,在甲、乙两容器中分别充入等物质的量的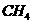 和
和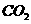 ,使甲、乙两容器初始容积相等。在相同温度下发生反应②,并维持反应过程中温度不变。已知甲容器中
,使甲、乙两容器初始容积相等。在相同温度下发生反应②,并维持反应过程中温度不变。已知甲容器中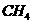 的转化率随时间变化的图像如图3所示,请在图3中画出乙容器中
的转化率随时间变化的图像如图3所示,请在图3中画出乙容器中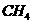 的转化率随时间变化的图像。
的转化率随时间变化的图像。
(3)反应③中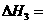 。800℃时,反应③的化学平衡常数K=1.0,某时刻测得该温度下的密闭容器中各物质的物质的量见下表:
。800℃时,反应③的化学平衡常数K=1.0,某时刻测得该温度下的密闭容器中各物质的物质的量见下表:

此时反应③中正、逆反应速率的关系式是 (填代号)。
a.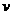 (正)
(正)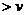 (逆) b.
(逆) b.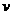 (正)<
(正)<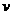 (逆)
(逆)
c.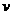 (正)=
(正)=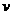 (逆) d.无法判断
(逆) d.无法判断
21.实验题(共9分)
(Ⅰ)(2分)某学生的实验报告所列出的下列数据中合理的是
A.用10mL量筒量取7.1mL稀盐酸
B.用托盘天平称量25.20g NaCl
C.用广泛pH试纸测得某溶液的pH为2.3
D.用25mL滴定管做中和滴定实验时,用去某浓度的碱溶液21.70mL
E.用浓度分别为0.50mol/L ,体积各为50mL盐酸、氢氧化钠溶液测定中和热
(Ⅱ)(7分)
用酸式滴定管准确移取25.00mL某未知浓度的盐酸于一洁净的锥形瓶中,然后用0.20mol·L-1的氢氧化钠溶液(指示剂为酚酞)滴定,滴定结果如下:
|
实验编号 |
NaOH起始读数 |
NaOH终点读数 |
|
第一次 |
0.10mL |
18.40mL |
|
第二次 |
3.00mL |
21.10mL |
|
第三次 |
0.20mL |
20.40mL |
|
第四次 |
0.00mL |
18.20mL |
(1)根据以上数据可以计算出盐酸的物质的量浓度为 mol·L-1(小数点后保留两位有效数字)。
(2)判断滴定终点的现象是 。
(3)以下操作可能造成测定结果偏高的是 (填写序号)。
A.配制标准溶液的氢氧化钠中混有Na2CO3杂质
B.滴定终点读数时,俯视滴定管的刻度,其它操作均正确
C.滴定到终点读数时发现滴定管尖嘴处悬挂一滴溶液
D.盛装未知液的锥形瓶用蒸馏水洗后,未用待测液润洗
E.未用标准液润洗碱式滴定管
20.(12分)已知电极材料:铁、铜、银、石墨、锌、铝;
电解质溶液:CuCl2溶液、Fe2(SO4)3溶液、盐酸。
按要求回答下列问题:
①电工操作上规定:不能把铜导线和铝导线连接在一起使用。请用电化学知识说明原因
。
②若电极材料选铜和石墨,电解质溶液选硫酸铁溶液,外加导线,能否构成原电池? (填“能”或“不能”),若能,请写出电极反应式,负极 ,正极 。
 ③若发生如下反应:Cu+2H+= Cu2++H2↑,请在右边框图内画出实现该反应的装置图(使用题目所给材料和药品)。
③若发生如下反应:Cu+2H+= Cu2++H2↑,请在右边框图内画出实现该反应的装置图(使用题目所给材料和药品)。
④若用石墨作电极,电解1L 0.1mol/L盐酸,当转移0.5mol电子时,阳极得到气体的体积(标况)为 L。
19.(7分)(1)Na2CO3的水溶液呈 性,原因是(用离子方程式表示):
(2)氯化铝水溶液呈 性 ,原因是(用离子方程式表示):____________ _
把AlCl3溶液蒸干,灼烧,最后得到的主要固体产物是 。
(3)在配制硫化钠溶液时,为了防止发生水解,可以加入少量的 。
(4)常温下,将浓度均为0.1mol/L的某一元酸HA和NaOH溶液等体积混合,混合后所得溶液的pH=9。则所得混合溶液中由水电离出的c(OH-)=________mol/L。
18.(8分)黄铁矿(主要成分为FeS2)是工业制取硫酸的重要原料,其煅烧产物为SO2和Fe3O4。
(1)450℃时,将0.050 mol SO2和0.030 mol O2放入容积为1 L的密闭容器中反应,在一定条件下达到平衡,测得c(SO3)=0.040 mol/L,放出3.932KJ的热量,则该条件下反应的平衡常数K为 ;升高温度,该平衡常数 (填“增大”或“减小”)。
(2)SO2的平衡转化率为 ;写出该反应的热化学方程式
。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com