
题目列表(包括答案和解析)
24. H2O2是一种重要的氧化剂,亦具有还原性。下列① ~ ④个涉及H2O2的反应(条件略)。
① Na2O2+HCl→NaCl + H2O2 (未配平)
② Ag2O+ H2O2 →2Ag +O2 + H2O
③ H2O2 →H2O+O2 (未配平)
④ H2O2 +Cr2(SO4)3+KOH→K2CrO4+K2SO4+H2O。(未配平)
据此,填写下列空白:
(1)反应③中当0.2mol H2O2参加反应时,转移电子___________个。
(2)标出反应②中电子转移的方向和数目:
Ag2O + H2O2 → 2Ag + O2 + H2O
(3)H2O2仅体现还原性的反应是_______(填代号),此反应中的氧化产物为__________。
(4)H2O2体现弱酸性的反应是_____(填代号),其理由为__________________________。
(5)配平反应④,将有关结果填写在下列方框中。


 H2O2
+ Cr2(SO4)3+ KOH
H2O2
+ Cr2(SO4)3+ KOH
23.巳知反为:aX(g) + bY(g) 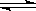 cZ(g),下表表示在一定温度(℃)和压强(大气压)作用下达到动态平衡时Z的含量。
cZ(g),下表表示在一定温度(℃)和压强(大气压)作用下达到动态平衡时Z的含量。
 Z含量 Z含量温度 |
 压强 压强 |
100 |
200 |
300 |
600 |
1000 |
|
200 |
81.5 |
86.4 |
89.9 |
95.4 |
98.8 |
|
|
300 |
52.0 |
64.2 |
71.0 |
84.2 |
92.6 |
|
|
400 |
25.1 |
38.2 |
47.0 |
65.2 |
79.8 |
|
|
500 |
10.6 |
19.1 |
26.4 |
42.2 |
57.5 |
分析表中数据,回答下列问题:
(1) 该反应是________反应(填“吸热”、“放热”)。
(2) 反应式中化学计量数a、b、c的关系是 a + b ____ c (填“>”、“<”、“=”)。
22.在100℃时,将0.1mol的N2O4气体充入1L抽空的密闭容器中,隔一定时间对该容器内的物质进行分析,得到如下表格,试填空
|
时间/S |
0 |
20 |
40 |
60 |
80 |
100 |
|
C(N2O4) (mol/L) |
0.10 |
C1 |
0.05 |
C3 |
a |
b |
|
C(NO2) (mol/L) |
0 |
0.06 |
C2 |
0.12 |
0.12 |
0.12 |
(1) 在0s~20s内N2O4的平均速率为 。
(2) 该反应的化学方程式为N2O4
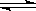 2NO2 +
Q(Q<0),在100℃时,该反应的平衡常数表达式K = ,到达平衡的时间为:
秒.
2NO2 +
Q(Q<0),在100℃时,该反应的平衡常数表达式K = ,到达平衡的时间为:
秒.
21.在密闭容器中进行可逆反应: CO(气)+NO2(气) 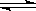 CO2(气)+NO(气)+热量,达到平衡后,只改变其中一个条件,对平衡的影响是(填“向左”、“向右”、“不移动”):
CO2(气)+NO(气)+热量,达到平衡后,只改变其中一个条件,对平衡的影响是(填“向左”、“向右”、“不移动”):
(1) 增大容器的体积,平衡 ,反应混合物的颜色 (填变深、变浅、不变)。
(2) 通人CO2气体,平衡 ,反应混合物的颜色 (填变深、变浅、不变)。
(3) 加入催化剂,平衡 。
20.两种金属的混合粉末15g,跟足量氯气充分反应时,所得固体增重35.5g,下列各组金属不能构成符合上述条件的混合物的是:( )
(A) Mg和Ag (B) Fe和Zn (C) Al和Fe (D) Mg和Al
19.已知Cu2S与某浓度的硝酸反应时,生成硝酸铜和硫酸,若反应中Cu2S与HNO3的物质的量之比为2:13,则该反应的还原产物为 ( )
(A) N2O (B) NO (C) NO2 (D) N2O3
18.把氧化钙放入蒸馏水中,一定时间后达到如下平衡:Ca(OH)2(s) 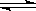 Ca2++2OH-。加入以下物质可使c(Ca2+)减少,而使c(OH-)增大的是( )
Ca2++2OH-。加入以下物质可使c(Ca2+)减少,而使c(OH-)增大的是( )
(A) 加入少量MgCl2固体 (B) 加入少量Na2CO3固体
(C) 加入少量NaOH固体 (D) 加入少量KCl晶体
17.C1SO3H称为氯磺酸,是一种强酸。对于反应:ClSO3H + HCOOH → CO + HCl + H2SO4有如下判断,其中较合理的是 ( )
(A) 此反应属于氧化还原反应 (B) 此反应不属于氧化还原反应
(C) 反应后溶液的pH值变小 (D) 反应后溶液的pH值增大
16.在密闭容器中,一定条件下,进行如下反应:
2NO(g)+2CO(g) 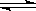 ?N2(g)+2CO2(g)+373.2 kJ;
?N2(g)+2CO2(g)+373.2 kJ;
达到平衡后,为提高该反应的速率和NO的转化率,采取的正确措施是( )
(A) 加催化剂 (B) 增大压强
(C) 升高温度 (D) 降低温度
15.化学反应速率与温度和反应物浓度成正比,反应 A+B → C 的反应速率方程式为:v = k c (A) c (B), v为反应速率, k为速率常数。当c (A) = c (B) = 1mol/L时,反应速率在数值上等于速率常数。下列说法正确的是( )
(A) 只增大c (A)时,v也增大 (B) 只增大c (A)时,v值不变
(C) 只升高温度时,k值不变 (D) 只升高温度时,k值变小
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com