
题目列表(包括答案和解析)
6.下列说法正确的是 ( )
A.增大反应物浓度,可增大单位体积内活化分子的数目,从而使反应速率增大
B.有气体参加的化学反应,若增大压强(即缩小反应容器的体积),可增加活化分子的百分数,从而使反应速率增大
C. pH值为7的溶液一定呈中性
D. pH=3的盐酸和pH=11的氨水溶液,溶质的浓度和导电能力均相同
5.常温时,在同体积pH=3的H2SO4、HNO3、CH3COOH溶液中,加入足量镁粉,下列说法正确的是( )
A.H2SO4中放出H2最多 B.HNO3比醋酸放出H2多
C.H2SO4和HNO3放出H2一样多 D.醋酸中放出H2最多
3.已知:①C(s) +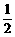 O2(g)
O2(g) CO(g);△H = – 110.5 kJ · mol – 1
②C(s) + O2(g) CO2(g);△H = –
393.51 kJ · mol – 1
则反应:C(s) + CO2(g) 2CO(g)的△H为
A.– 283.01 kJ · mol – 1 B.+ 172.51 kJ · mol – 1
C.+ 283.01 kJ · mol – 1 D.+ 504.00 kJ · mol – 1
4.体积不变的密闭容器中进行如下反应: X2(g) + 3Y2(g)2Z(g),X2、Y2、Z起始浓度分别为0.2mol.L-1 、 0.6mol.L-1 、0.4mol.L-1 ,当平衡时,下列数据肯定不对的是
A. X2为0.4mol.L-1,Y2为1.2mol.L-1 B. Y2为1.0mol.L-1
C. X2为0.3mol.L-1,Z为0.2mol.L-1 D. Z为0.6mol.L-1
2.在2A + B 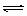 3C + 4D中,表示该反应速率最快的是( )
3C + 4D中,表示该反应速率最快的是( )
A.υ(A) = 0.5mol•L-1•s-1 B.υ(B) = 0.3 mol•L-1•s-1
C.υ(C) = 0.8mol•L-1•s-1 D.υ(D)= 1 mol•L-1•s-1
1.对于任何一个平衡体系,采用以下措施,一定会使平衡移动的是 ( )
A.加入一种反应物 B.升高温度 C.对平衡体系增加压强 D.使用催化剂
29.石膏是一种节能建筑材料。某石膏样品是由二水石膏(CaSO4·2H2O)、半水石膏(CaSO4·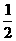 H2O)、无水石膏(CaSO4)三种成分组成,各组分含量可用下列方法测定。
H2O)、无水石膏(CaSO4)三种成分组成,各组分含量可用下列方法测定。
①称取8.70 g该石膏试样,在400℃干燥失去全部结晶水,质量变为8.16 g。
②再称取8.70 g的该石膏试样,加入80%的酒精溶液,使CaSO4完全水化成CaSO4·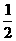 H2O,此时,其它两组分与酒精溶液不起作用;将试样取出干燥后称量,试样质量变为8.97 g。
H2O,此时,其它两组分与酒精溶液不起作用;将试样取出干燥后称量,试样质量变为8.97 g。
③在②中所得8.97 g试样中加入蒸馏水,使全部的CaSO4·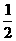 H2O都水化成CaSO4·2H2O,取出干燥后再次称量,质量变为10.32 g。
H2O都水化成CaSO4·2H2O,取出干燥后再次称量,质量变为10.32 g。
(1)试样中结晶水的质量分数为__________________。
(2)试样中无水石膏(CaSO4)的物质的量为____________ mol。
(3)试样中三种石膏的物质的量之比为:
n (CaSO4·2H2O)∶n
(CaSO4·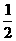 H2O)∶n (CaSO4)=
__________________。
H2O)∶n (CaSO4)=
__________________。
190.720g) ,利用下图装置测定混合物中Na2O2的质量分数,每隔相同时间读得电子天平的数据如表:
|
|
读数次数 |
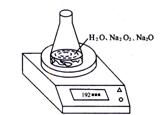 质量/g 质量/g |
|
锥形瓶+水 +试样 |
第l 次 |
192.214 |
|
第2 次 |
192.164 |
|
|
第3 次 |
192.028 |
|
|
第4 次 |
192.010 |
|
|
第5 次 |
192.010 |
(l)写出Na2O2和H2O 反应的化学方程式__________________________________.
(2)计算过氧化钠质量分数时,必需的数据是____________________ (填写必要的数值),不需要第6 次称量的原因_______________________________ ;Na2O2的质量分数为
____________________(填写计算结果)。
(3)测定上述样品(1.560 g)中Na2O2质量分数的另一种方案,其操作流程如下:
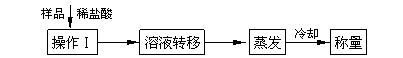

① 操作Ⅰ的名称是_____________________。
② 需直接测定的物理量是_______________、_________________(文字回答)。
③ 测定过程中需要的仪器有电子天平、蒸发皿、酒精灯,还需要_________________、_________________________(固定、夹持仪器除外)。
(4)某同学为测定上述样品(0.1560 g)中Na2O2质量分数,有如下实验装置可供选用:



① 为了确保实验的精确度,量气装置选A,则应选取用的发生装置是_____(填编号)。
② 用A装置量气,读数时应进行的操作是____________________________________。
③ 如果量气管的正确读数为50.35 mL,样品的质量为0.1560 g,为了计算样品的质量分数,还需要的数据是________________(文字回答)。
28.某种含有少量氧化钠的过氧化钠试样(已知试样质量为1.560 g、锥形瓶和水的质量为
27.有反应 ① Fe(s) + CO2(g) 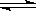 CO(g) + FeO(s) 的平衡常数为K1;
CO(g) + FeO(s) 的平衡常数为K1;
反应 ② Fe(s) + H2O(g) 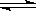 FeO(s) + H2(g) 的平衡常数为K2。
FeO(s) + H2(g) 的平衡常数为K2。
|
温度(K) |
K1 |
K2 |
|
973 |
1.47 |
2.38 |
|
1173 |
2.15 |
X |
在不同温度下K1和K2的值如下表:
(1) 写出K1的平衡常数表达式:K1 = __________。
(2) 反应② 在升高温度时,固体的质量有减小的趋势,据此可判断X的值______2.38(答 > 、<、 =)。
(3) 推导反应:CO2(g)
+ H2(g) 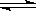 CO(g)
+ H2O(g) 的平衡常数K与K1、K2的关系式K=___________________。
CO(g)
+ H2O(g) 的平衡常数K与K1、K2的关系式K=___________________。
(4) 在10L的密闭容器中加入0.4 mol的CO2和0.2 mol 的H2在一定条件下发生:
CO2(g) + H2(g)  CO(g) + H2O(g)
CO(g) + H2O(g)
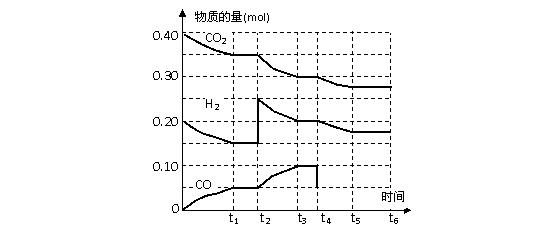 反应中各物质的物质的量与时间的关系如右图所示:反应进行到t2时,曲线发生变化的原因是_______________________________________(文字回答);
反应中各物质的物质的量与时间的关系如右图所示:反应进行到t2时,曲线发生变化的原因是_______________________________________(文字回答);
反应进行到t3时达到平衡,在t4时改变条件,并在t5时重新达到平衡,请在图中用实线画出从t4到t6 时间内CO变化情况。
25.废旧印刷电路板的回收利用可实现资源再生,并减少污染。废旧印刷电路板经粉碎分离,能得到非金属粉末和金属粉末。
(1)用一定浓度的硝酸可溶出印刷电路板金属粉末中的铜。配平下列反应的方程式:
____Cu +____HNO3 →____Cu(NO3)2 +____ N2O3 +____H2O
该反应中,发生氧化反应的过程是_________→________;还原产物是__________ 。
(2)①用H2O2和H2SO4的混合溶液可溶出印刷电路板金属粉末中的铜。反应中的氧化剂是__________(填化学式);与硝酸比较,使用H2O2溶解铜的优点是__________________
___________________________________________。
②标出该反应中电子转移的方向和数目(不要求写出配平结果)
Cu + H2O2 + H2SO4 →
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com