
题目列表(包括答案和解析)
6、下列系统命名正确的
A、3-甲基丁烷 B、2,2-甲基丙烷
C、2-甲基-3-乙基戊烷 D、2-乙基己烷
5、下列叙述中正确的是
A、利用油脂在酸性条件下水解,可以生产甘油和肥皂
B、合成纤维和人造纤维统称化学纤维
C、淀粉和纤维素分子式都为(C6H10O5)n而它们的结构不同,所以它们互为同分异构体
D、高聚物可分成线型和体型两种,其中体型高聚物是热塑性的。
4、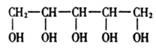 木糖醇是一种新型的甜味剂,它具有甜味足,溶解性好,防踽齿,适合糖尿病患者的需要。它是一种白色粉末状的结晶,结构简式为:
木糖醇是一种新型的甜味剂,它具有甜味足,溶解性好,防踽齿,适合糖尿病患者的需要。它是一种白色粉末状的结晶,结构简式为:
下列有关木糖醇的叙述中不正确的是
A、木糖醇是-种单糖,不能发生水解反应
B、木糖醇在铜催化下能被氧气氧化,氧化产物能发生银镜反应
C、木糖醇易溶解于水,能发生酯化反应
D、2mol木糖醇与足量的钠反应最多可产生5molH2
3、甲烷分子中所有氢原子用甲基取代得C(CH3)4,再将C(CH3)4中所有氢原子用甲基取代得
C[C(CH3) 3]4。则C[C(CH3)3]4的一氯取代物有
A、12种 B、4种 C、2种 D、1种
2、在核磁共振氢谱中出现两组峰,且其峰面积之比为3∶1的化合物是
1、前期H1N1甲流在我市也大面积传染,影响了生产、生活和学习。达菲(Tamiflu)被认为是目前世界上公认的能够治疗H1N1甲流病毒的有效药物,它是由我国特有中药材八角的提取物-莽草酸(shikimicacid)为原料合成的。已知莽草酸和达菲的结构简式如下:下列判断正确的是
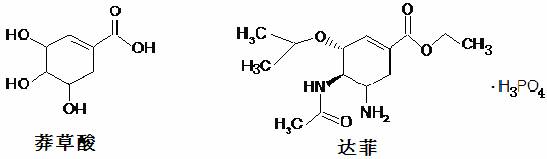
A.它们互为同系物 B.莽草酸能使溴的四氯化碳溶液褪色,达菲不能
C.达菲在热的NaOH溶液中能稳定存在 D.莽草酸的分子式为C7H10O5
14.(20分)20世纪30年代,Eyring和Pelzer在碰撞理论的基础上提出化学反应的过渡态理论:化学反应并不是通过简单的碰撞就能完成的,而是在反应物到生成物的过程中经过一个高能量过渡态。分析图中信息,回答下列问题:
(1)图一是NO2和CO反应生成CO2和NO过程中能量变化示意图,请写出NO2和CO反应的热化学方程式: 。在反应体系中加入催化剂,E1和E2的变化是:E1_________,E2________(填“增大”、“减小”或“不变”),对反应热是否有影响?_______________,原因是_________
。
(2)图二是红磷P(s)和Cl2(g)发生反应生成PCl3(g)和PCl5(g)的反应过程与能量关系图(图中的△H表示生成1mol产物的数据)。根据图二回答下列问题:
① P(s)和Cl2(g)反应生成PCl3(g)的热化学方程式 。
PCl5(g)分解成PCl3(g)和Cl2(g)的热化学方程式 。
② P(s)和Cl2(g)分两步反应生成1molPCl5(g)的△H1与P(s)和Cl2(g)一步反应生成1molPCl5(g)的△H2关系是:△H2______ △H1(填“大于”、“小于”或“等于”),原因是
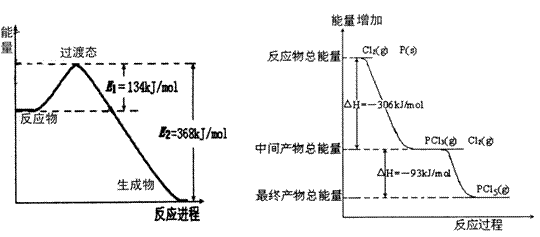 。
。
图一 图二
13.(10分)常温常压下,断裂1mol(理想)气体分子化学键所吸收的能量或形成1mol(理想)气体分子化学键所放出的能量称为键能(单位为KJ.mol-1)下表是一些键能数据(KJ·mol-1)
|
化学键 |
键能 |
化学键 |
键能 |
化学键 |
键能 |
|
C-F |
427 |
C-Cl |
330 |
C-I |
218 |
|
H-H |
436 |
S=S |
255 |
H-S |
339 |
回答下列问题:
(1)由表中数据规律预测C-Br键的键能范围:_________ <C-Br键能<__________
(2)热化学方程式2H2(g)+S2(g) ==2H2S(g);△H= QKJ·mol-1;则Q=
(3)
 已知下列热化学方程式:
已知下列热化学方程式:
O2 (g) == O+2(g)
+ e-
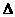 H1= +1175.7 kJ·mol-1
H1= +1175.7 kJ·mol-1
 PtF6(g) + e-== PtF6-(g)
PtF6(g) + e-== PtF6-(g)
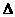 H2= -771.1 kJ·mol-1
H2= -771.1 kJ·mol-1
 O2+PtF6-(s) == O2+(g) + PtF6-(g)
O2+PtF6-(s) == O2+(g) + PtF6-(g)  H3= +482.2 kJ·mol-1
H3= +482.2 kJ·mol-1
 则反应O2(g) +
(g) = O2+PtF6- (s)的
则反应O2(g) +
(g) = O2+PtF6- (s)的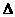 H=_____________ kJ·mol-1。
H=_____________ kJ·mol-1。
12.(8分)由磷灰石[主要成分]在高温下制备黄磷(P4)的热化学方程式为:
4Ca5(PO4)3F(s)+21SiO2(s)+30C(s) ==3P4(g)+20CaSiO3(s)+30CO(g)+SiF4(g)
;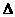 H
H
(1)上述反应的副产物还可以进行综合利用,其中矿渣 可以用来制造
,尾气经分离除去SiF4(g) 后 可以用来制造 等。
已知相同条件下:
4Ca3(PO4)2F(s)+3SiO2(s)=6Cas3(PO4)2(s)+2CaSio3(s)+SiF4(g)
;
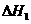
2Ca3(PO4)2(s)+10C(s)=P4(g)+6CaO(s)+10CO(g); 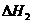
SiO2(s)+CaO(s)=CaSiO3(s) ; 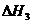
用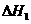 、
、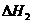 和
和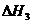 表示
表示 H,
H, H
H =
=
11.(12分)某研究小组将V1 mL 1.0 mol/L HCl溶液和V2 mL未知浓度的NaOH溶液混合均匀后测量并记录溶液温度,实验结果如下图所示(实验中始终保持V1+V2=50 mL)。回答下列问题:
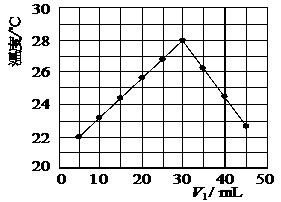
(1)研究小组做该实验时环境温度 (填“高于”、“低于”或“等于”)22 ℃,判断的依据是
。
(2)由题干及图形可知,V1/V2= : 时,酸碱恰好完全中和,此反应所用NaOH溶液的浓度应为 mol/L。
(3)若通过实验测定及有关计算知此反应共放出Q KJ的热量,请写出此反应的热化学方程式:
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com