
题目列表(包括答案和解析)
5、对于工业制硫酸中接触室内的反应:2SO2(g)+O2 (g)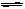 2SO3(g) △H<0 。达到平衡时,只改变下列一个条件,平衡不发生移动的是:
2SO3(g) △H<0 。达到平衡时,只改变下列一个条件,平衡不发生移动的是:
A. 升高温度 B. 恒温、恒容充入氧气
C. 恒温恒容充入SO3 D. 加入催化剂V2O5
4、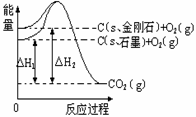 已知25℃、101kPa下,如右题图所示,石墨的燃烧热为393.51kJ/mol,金刚石的燃烧热为395.41kJ/mol 。下列说法或表达正确的是:
已知25℃、101kPa下,如右题图所示,石墨的燃烧热为393.51kJ/mol,金刚石的燃烧热为395.41kJ/mol 。下列说法或表达正确的是:
A. 金刚石比石墨稳定
B. C(s、石墨)=C(s、金刚石) △H=+1.9 kJ/mol
C. △H1<△H2
D. 如果使用催化剂,△H1和△H2都变小
3、 模型法是化学中把微观问题宏观化的最常见方法,对于2HBr(g) H2(g)+Br2(g) 反应。下列四个图中可以表示该反应在一定条件下达到平衡状态的是:
H2(g)+Br2(g) 反应。下列四个图中可以表示该反应在一定条件下达到平衡状态的是:
2、下列说法不正确的是:
A. 煤、石油、天然气属于化石能源,太阳能、氢能、风能、地热能、海洋能属于新能源
B. 测试和调控溶液的pH对工农业生产、科学研究及日常生活和医疗保健都有重要意义。
C. 利用盐类的水解反应可以制备胶体对饮用水进行净化,也可以获得纳米材料。
D. 化学电池必须回收处理,其主要目的就是回收碳棒再利用。
1、下列叙述正确的是:
A.只有反应体系中所有分子同时都发生有效碰撞的反应才是放热反应。
B. 通常条件下能够自发进行的反应必须具备△H和△S均大于0
C.任何化学反应只要是自发进行的放热反应都可以被设计成原电池,为外界提供电能。
D. 强电解质和弱电解质的本质区别就是在水溶液中是否全部电离。
26.(10分)如图所示,若电解5min时铜电极增重2.16g,试回答:
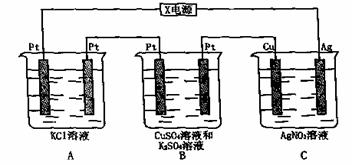
(1)电源电极X名称为 。C装置是 池;
(2)pH变化为:A ;B ;C ;
(3)通电5min时,B中共收集224mL气体(标准状况),溶液体积为200mL(设电解前后体积没变化)则通电前硫酸铜溶液的物质的量浓度是多少?
(4)若A中KCl溶液的体积也是200mL,电解后,溶液的pH是多少?(设电解前后体积无变化)
天津市塘沽区09-10学年高二上学期期末质量检测
25.(8分) 某原电池中,电解质溶液为稀H2SO4,分别向负极通入H2,向正极通入O2
(1)当分别通入H2和O2时:
① 正极反应:__________________;② 负极反应:________________;
③ 电池总反应:_______________;④ 电解质溶液pH的变化_____。(填“增大”“减小”或“不变”。下同)
(2)若电解质溶液为NaOH时,当分别通入CH4和O2时:
① 正极反应:______________;② 负极反应:____________;
③ ③ 电池总反应:_______________;电解质溶液pH的变化:____________。
24. (10分)已知某溶液中只存在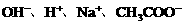 四种离子,某同学推测其离子浓度大小顺序有如下四种关系:
四种离子,某同学推测其离子浓度大小顺序有如下四种关系:
①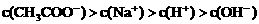
②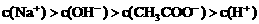
③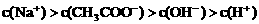
④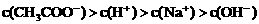
填写下列空白:
(1) 若溶液中溶解了一种溶质,则该溶质是______________,则该溶液中四种离子浓度的大小顺序符合上述4种关系中的______________。(填序号),
物料守恒表达式为
(2)若上述关系①是正确的,则溶液中的溶质为______________;若上述关系②是正确的,则溶液中的溶质为______________。这两种溶液的电荷守恒表达式相同,则电荷守恒表达式为
(3)若该溶液是由体积相等的NaOH溶液和醋酸混合而成,且恰好呈中性,则混合前c(NaOH) ______________c(CH3COOH)(填“大于”、“小于”、或“等于”,下同),混合后溶液中C(CH3COO-)______________C(Na+)
23.(8分) 将1molI2(g)和2molH2置于某2L密闭容器中,在一定温度下发生反应:
I2(g)+H2(g)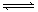 2HI(g);△H<0,并达平衡,HI的体积分数ω(HI)
2HI(g);△H<0,并达平衡,HI的体积分数ω(HI)
随时间变化如图曲线(II)所示
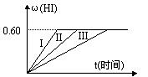
(1)达平衡时,I2(g)的物质的量浓度为 。
(2)若改变反应条件下,在甲条件下ω(HI)的变化如图曲线(I)所示,在乙条件下ω(HI)的变化如图曲线(III)所示。则甲条件可能是 (填入下列条件的序号。下同),乙条件可能是 。
① 恒容条件下,升高温度
② 恒容条件下,降低温度
③ 恒温条件下,缩小反应容器体积
④ 恒温条件下,扩大反应容器体积
⑤ 恒温恒容条件下,加入适当催化剂
(3)若保持温度不变,在另一相同的2L密闭容器中加入a mol I2(g)、b mol H2和c mol HI(a、b、 c均大于0),发生反应,达平衡时,HI的体积分数仍为0.60,则a、b、c的应满足的关系是 (用含一个a、b、c的代数式表示)
22.(10分)某学生为测定未知浓度的硫酸溶液,实验如下:用1.00mL待测硫酸配制100mL稀H2SO4溶液;以0.14mol·L-1的NaOH溶液滴定上述稀H2SO4 25.00mL,滴定终止时消耗NaOH溶液15.00mL。
(1)该学生用标准NaOH溶液0.14mol·L-1滴定硫酸的实验操作如下:
A.用酸式滴定管取稀H2SO4 25.00mL,注入锥形瓶中,加入指示剂。
B.用待测定的溶液润洗酸式滴定管
C.用蒸馏水洗干净滴定管
D.取下碱式滴定管用标准的NaOH溶液润洗后,将标准液注入碱式滴定管刻度“0”以上2-3cm处,再把碱式滴定管固定好,调节液面至刻度“0”或“0”刻度以下
E.检查滴定管是否漏水
F.另取锥形瓶,再重复操作一次
G.把锥形瓶放在滴定管下面,瓶下垫一张白纸,边滴边摇动锥形瓶直至滴定终点,记下滴定管液面所在刻度
(1)①滴定操作的正确顺序是(用序号填写)____ ___ _______;
②该滴定操作中应选用的指示剂是_____ ________;
③在G操作中如何确定终点?_____ ________________________________。
(2)碱式滴定管用蒸馏水润洗后,未用标准液润洗导致滴定结果(填“偏小”、“偏大”或“恰好合适”)_________________。
(3)配制准确浓度的稀H2SO4溶液,必须使用的主要容器是_______________________。
(4)如有1mol/L和0.1mol/L的NaOH溶液,应用_____________的NaOH溶液,原因是______________________________________________________ ____。
(5)用标准NaOH液滴定时,应将标准NaOH溶液注入______(选填“甲”或“乙”)中。
(6)观察碱式滴定管读数时,若滴定前仰视,滴定后俯视,则结果会导致测得的稀H2SO4溶液浓度测定值_____________(选填“偏大”“偏小”或“无影响”)。
(7)计算待测硫酸(稀释前的硫酸)溶液的物质的量浓度(计算结果到小数点后二位)
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com