
题目列表(包括答案和解析)
14、在锌与某浓度的盐酸起反应的实验中,一个学生得到下面的结果:
|
序号 |
锌的质量/g |
锌的形状 |
温度/℃ |
完全溶解于酸的时间/s |
|
A |
2 |
薄片 |
5 |
400 |
|
B |
2 |
薄片 |
15 |
200 |
|
C |
2 |
薄片 |
25 |
100 |
|
D |
2 |
薄片 |
30 |
t1 |
|
E |
2 |
薄片 |
35 |
50 |
|
F |
2 |
颗粒 |
15 |
t2 |
|
G |
2 |
粉末 |
15 |
t3 |
则下列说法正确的是:
① t1=75s ② t2>200>t3 ③ 单位时间内消耗的锌的质量mG>mF>mB
A. ① B. ①② C. 只有② D. 全部正确
第Ⅱ卷(共计58分)
0.1mol/L的NaCl溶液至不再有白色
沉淀生成,再向其中滴加0.1mol/L
的Na2S溶液,白色沉淀转化为黑色沉淀。
其沉淀转化的反应方程式为:
2AgCl(s)+S2-(aq)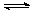 Ag2S(s)+2Cl-(aq) 。
Ag2S(s)+2Cl-(aq) 。
13、 某温度时,AgCl在水中的沉淀溶解平衡曲线如图所示(提示:AgCl(s)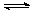 Ag+(aq)+Cl-(aq),其平衡常数Ksp=c(Ag+)·c(Cl-),称为溶度积常数;又知:
Ag+(aq)+Cl-(aq),其平衡常数Ksp=c(Ag+)·c(Cl-),称为溶度积常数;又知:
Ksp(AgCl)=1.8×10-10,Ksp(Ag2S)=6.3×10-50)。下列说法正确的是:
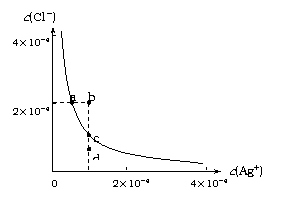 A. 加入NaCl可以使溶液由a点变到b点
A. 加入NaCl可以使溶液由a点变到b点
B. b点和d点均无AgCl沉淀生成
C. a点对应的Ksp大于c点对应的Ksp
D. 向0.1mol/L的硝酸银溶液中滴加
12、 某温度下按右图安装好实验装置,在锥形瓶内盛6.5g锌粒(颗粒大小基本相同),通过分液漏斗加入40mL 2.5mol/L的硫酸,将产生的H2收集在一个注射器中,用时10s时恰好收集到气体的体积为50mL(若折合成0℃、101kPa条件下的H2体积为44.8mL), 在该温度下,下列说法不正确的是:
某温度下按右图安装好实验装置,在锥形瓶内盛6.5g锌粒(颗粒大小基本相同),通过分液漏斗加入40mL 2.5mol/L的硫酸,将产生的H2收集在一个注射器中,用时10s时恰好收集到气体的体积为50mL(若折合成0℃、101kPa条件下的H2体积为44.8mL), 在该温度下,下列说法不正确的是:
A. 用锌粒来表示10s内该反应的速率为0.013g/s
B. 忽略锥形瓶内溶液体积的变化,用H+来表示10s内该反应的速率0.01mol/(L·s)
C. 忽略锥形瓶内溶液体积的变化,用Zn2+来表示10s内该反应的速率0.01mol/(L·s)
D. 用H2来表示10s内该反应的速率为0.004mol/(L·s)
11、某温度下,对于反应N2(g)+3H2(g)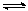 2NH3(g) △H=-92.4kJ/mol。
2NH3(g) △H=-92.4kJ/mol。
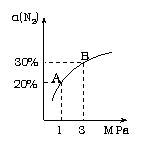 N2的平衡转化率(α-%)与体系总压强(P)的关系
N2的平衡转化率(α-%)与体系总压强(P)的关系
如右图所示。下列说法正确的是:
A. 将1.0mol氮气、3.0mol氢气,置于1L密闭容器中
发生反应,放出的热量为92.4kJ。
B. 平衡状态由A变到B时,平衡常数K(A) < K(B) 。
C. 上述反应在达到平衡后,增大压强,H2的转化率提高。
D. 升高温度,平衡向逆反应方向移动,说明逆反应速率增大,正反应速率减小。
10、其他条件不变的情况下,下列说法不正确的是:
A. 对于反应nA(g)+B (g)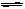 2C(g),平衡后增大压强,A的百分含量减小,则n≥2。
2C(g),平衡后增大压强,A的百分含量减小,则n≥2。
B. 对于反应2A(g)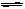 B(g) △H<0,若体系温度不再变化说明反应达到平衡状态。
B(g) △H<0,若体系温度不再变化说明反应达到平衡状态。
C. 对于反应2A(g)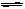 B(g),恒温、恒容条件下气体密度不再变化说明反应达到平衡状态。
B(g),恒温、恒容条件下气体密度不再变化说明反应达到平衡状态。
D. 对于反应2A(g)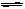 B(g),若ν(A)正=2ν(B)逆,说明反应达到平衡状态。
B(g),若ν(A)正=2ν(B)逆,说明反应达到平衡状态。
9、中学化学教材中有大量数据,下列为某同学对数据的利用情况,其中不正确的是:
A. 用溶解度数据判断煮沸Mg(HCO3)2溶液得到的产物是Mg(OH)2而不是MgCO3 。
B. 用pH数据推测不同强酸弱碱盐在水溶液中水解程度的大小。
C. 用反应热数据的大小判断不同反应的反应速率的快慢。
D. 用平衡常数的大小判断化学反应可能进行的程度。
8、 市场上经常见到的标记为Li-ion的电池称为“锂离子电池”。它的负极材料是金属锂和碳的复合材料(碳作为金属锂的载体),电解质为一种能传导Li+的高分子材料。这种锂离子电池的电池反应为:Li+2Li0.35NiO2
2Li0.85NiO2。下列说法不正确的是:
市场上经常见到的标记为Li-ion的电池称为“锂离子电池”。它的负极材料是金属锂和碳的复合材料(碳作为金属锂的载体),电解质为一种能传导Li+的高分子材料。这种锂离子电池的电池反应为:Li+2Li0.35NiO2
2Li0.85NiO2。下列说法不正确的是:
A.放电时,负极的电极反应式:Li-e-=Li+
B.放电和充电过程恰好相反,则充电时,Li0.85NiO2既发生氧化反应又发生还原反应
C.该电池不能用水溶液作为电解质
D.放电过程中Li+向负极移动
7、从下列实验事实所引起的相应结论不正确的是:
|
选项 |
实 验 事 实 |
结 论 |
|
A |
其它条件不变, 0.01mol/L的KMnO4酸性溶液分别与0.1mol/L的H2C2O4溶液和0.2mol/L的H2C2O4溶液反应,后者褪色时间短。 |
当其它条件不变时,增大反应物浓度可以使化学反应速率加快 |
|
B |
其它条件不变,分别将等体积、等物质的量浓度的Na2S2O3溶液和H2SO4混合液放在冷水和热水中,放在热水中的混合液先出现浑浊。 |
当其它条件不变时,反应体系的温度越高、化学反应速率越快 |
|
C |
将少量MnO2粉末加入盛有10%双氧水的锥形瓶内,在化学反应前后,MnO2的质量和化学性质都没有发生改变。 |
催化剂虽然可以加快化学反应的速率,但一定不参与化学反应过程 |
|
D |
一定条件下,分别在容积为1L和容积为2L的两个密闭容器中加入等量的氢气和碘蒸气,发生如下反应:H2(g)+I2(g)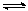 2HI(g),获得等量HI时需要的时间前者少。 2HI(g),获得等量HI时需要的时间前者少。 |
当其它条件不变时,气态反应体系的压强越大、化学反应速率越快 |
6、下列说法正确的是:
A.95℃时纯水的pH<7,说明加热可以使纯水呈酸性。
B.25℃时,pH=12的某溶液中,由水电离出的c(OH-)一定为1×10-2mol/L。
C.pH=3的醋酸溶液,稀释至10倍后pH=4。
D.实验室通常将固态氯化铁溶解在盐酸中,再稀释到相应浓度来配制FeCl3溶液。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com