
题目列表(包括答案和解析)
对多电子原子的核外电子,按能量的差异将其分成不同的能层(n);各能层最多容纳的电子数为2n2。对于同一能层里能量不同的电子,将其分成不同的能级(l);能级类型的种类数与能层数相对应;同一能层里,能级的能量按s、p、d、f的顺序升高,即E(s)<E(p)<E(d)<E(f)。
各能层所包含的能级类型及各能层、能级最多容纳的电子数见下表:
|
能 层(n) |
一 |
二 |
三 |
四 |
五 |
六 |
七 |
||||||
|
符 号 |
K |
L |
M |
N |
O |
P |
Q |
||||||
|
能 级(l) |
1s |
2s |
2p |
3s |
3p |
3d |
4s |
4p |
4d |
4f |
5s |
… |
…… |
|
最 多
电 子 数 |
2 |
2 |
6 |
2 |
6 |
10 |
2 |
6 |
10 |
14 |
2 |
… |
…… |
|
2 |
8 |
18 |
32 |
…… |
2n2 |
量子力学告诉我们:ns能级各有1个轨道,np能级各有3个个轨道,nd能级各有5个轨道,nf能级各有7个个轨道.而每个轨道里最多能容纳2个电子,通常称为电子对,用方向相反的箭头“↑↓”来表示。
一个原子轨道里最多只能容纳2个电子,而且自旋方向相反,这个原理成为泡利原理。
当电子排布在同一能级的不同轨道时,总是优先单独占据一个轨道而且自旋方向相反 ,这个规则是洪特规则。
洪特规则的特例:对于同一个能级,当电子排布为全充满、半充满或全空时,是比较稳定的。
(1)电子运动的特点:①质量极小 ②运动空间极小 ③极高速运动。
电子云:电子在原子核外空间一定范围内出现,可以想象为一团带负电荷的云雾笼罩在
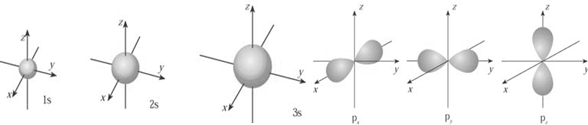
原子核的周围,人们形象地把它叫做“电子云”称作电子云 。电子云轮廓图称原子轨道。S的原子轨道是球的,能层序数越大,原子轨道的半径越大。
s电子的原子轨道呈球形对称,ns能级各有1个原子轨道;p电子的原子轨道呈纺锤形,np能级各有3个原子轨道,相互垂直(用px、py、pz表示);nd能级各有5个原子轨道;nf能级各有7个原子轨道。如O:
27.(1) 。B和C属于 。
(2) 。(3) 。
24.(1) ;(2) ;
。
23.m= ,n= ,p= , 。
22. ;
。
21.① ;
② ; ③ ;④ 。
20.(1) 。
(2) 。
(3) 。
19. ; ; 。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com